下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
蔗糖溶液中加稀硫酸,加热,滴加新制备的Cu(OH)2,再加热 |
未产生砖红色沉淀 |
蔗糖未发生水解 |
| B |
将一铝箔放在酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C |
铜放入稀硫酸中,再加入硝酸钠固体 |
开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 |
硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |
将CO2通入水玻璃溶液中 |
生成白色胶状沉淀 |
证明Si元素的非金属性大于C |
用1 mol·L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积分别是
| A.0.5 mol·L-1 100 mL | B.0.5 mol·L-180 mL |
| C.1 mol·L-160 mL | D.1 mol·L-180 Ml |
下列关于化学反应的熵变的叙述中,正确的是
| A.化学反应的熵变与反应的方向无关 |
| B.化学反应的熵变直接决定了反应的方向 |
| C.熵变为正的反应都是混乱度增大的反应 |
| D.能自发进行的反应熵变一定都为正 |
下列事实中不能用勒夏特列原理来解释的是
| A.向H2S水溶液中加入NaOH固体有利于S2-增多 |
| B.鼓入过量空气有利于SO2转化为SO3 |
| C.高压对合成氨有利 |
| D.500 ℃左右比室温更有利于氨的合成 |
有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列有关硅的说法中,不正确的是
| A.高纯度的硅广泛用于制作计算机芯片 |
| B.硅可由二氧化硅还原制得 |
| C.低温时,硅与水、空气和盐酸不反应,但能与氢氟酸反应 |
| D.自然界中硅的储量丰富,自然界中存在大量的单质硅 |
X、Y、Z、M、W为短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的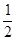 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.由X元素形成的单质不一定是原子晶体 |
| C.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |