通过下列方法测定1.80g金属Sn样品的纯度。
①将样品溶于盐酸:Sn+2HCl=SnCl2+H2↑;
②加过量FeCl3溶液:SnCl2+2FeCl3=SnCl4+2FeCl2;
③再用酸性KMnO4反应生成的Fe2+,用去0.1000mol/L的KMnO4溶液60.00mL,反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。计算金属Sn样品的纯度为
| A.99.2% | B.49.6% | C.96.2% | D.46.6% |
下列化合物属于弱电解质的是
| A.HClO4 | B.Ba(OH)2 | C.CO2 | D.HF |
纯水在20℃和80℃时的pH
| A.前者大 | B.后者大 | C.相等 | D.无法确定 |
将O2、CH4、Na2O2放入密闭容器中,在150℃条件下用电火花引燃,充分反应后,容器中无气体,且将残余物溶于水中无气体放出。则O2、CH4、Na2O2的物质的量之比与反应后容器内固体的成分为
| A.1:2:6 ;Na2CO3和NaHCO3 | B.2:1:4 ;Na2CO3 |
| C.1:2:6; Na2CO3和NaOH | D.2:1:4; Na2CO3和NaOH |
24mL浓度为 0.05 mol·L-1的Na2SO3溶液恰好与20mL浓度为 0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价是
| A.+2 | B.+3 | C.+4 | D.+5 |
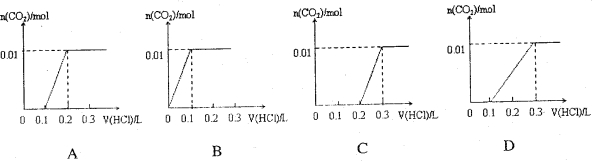
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是