在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
| |
反应物 |
催化剂 |
温度 |
| ① |
10mL10% H2O2溶液 |
无 |
25℃ |
| ② |
10mL20% H2O2溶液 |
无 |
25℃ |
| ③ |
10mL20% H2O2溶液 |
无 |
40℃ |
| ④ |
10mL20% H2O2溶液 |
1~2滴0.1mol/LFeCl3溶液 |
40℃ |
通过实验得到氧气的体积与时间的关系如右图所示,
回答下列问题:
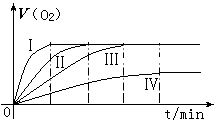
(1)代表实验①的图示是 。
(2)对比实验③和④的目的是 。
(3)通过上面对比实验,所得的实验结论是 。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3 mol H2,一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),测得其中N2物质的
2NH3(g),测得其中N2物质的 量随时间变化如图所示。回答下列问题:
量随时间变化如图所示。回答下列问题:
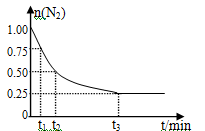
(4)从开始反应到t2时刻,氨气的平均反应速率为 。
(5)在t3时刻,氢气的转化率为 。
(8分,每空2分)现要配制1 mol·L-1 Na2CO3溶液250mL,求:①需要固体Na2CO3________g;②需要含结晶水的碳酸钠晶体(Na2CO3·10H2O) ________g;③需要物质的量浓度为4 mol·L-1的Na2CO3溶液________mL;④需要溶质的质量分数为12%、密度为1.12g·cm-3的Na2CO3溶液________mL。
(8分,每空2分)有四瓶失去标签的溶液A、B、C、D,它们可能分别是硫酸、盐酸、碳酸钠和硝酸钾溶液中的某一种。各取少量分别放入四支试管里,先向各试管中滴加BaCl2溶液,则A、B有白色沉淀,C、D无明显现象,再向A、B白色沉淀中加入稀硝酸,则A试管中白色沉淀溶解,并有无色气体产生,B试管无变化。另取C、D各少量,分别加入AgNO3溶液,则C试管有白色沉淀,D试管无变化。由此判断:(填化学式)
A.B.C.D.
食物是人类赖以生存的物质基础,食物中能够被人体消化、吸收和利用的各种营养物质称为营养素。回答下列问题:
(1)人体需要的营养素主要有糖类、蛋白质、维生素、水、和。
(2)下列病患是由于缺乏维生素引起的是
A.夜盲症 B.佝偻病 C.坏血病
(3)往KMnO4溶液中滴入维生素C溶液,KMnO4溶液褪色说明维生素C具有性
(4)有关维生素C说法不正确的是
A.蔬菜应先洗后切 B.蔬菜应慢火慢煮
C.维生素C可使溴水褪色 D.维生素C可做用食品添加剂
填空题
(1)学生要注意合理膳食,注意食品的多样化,防止某种营养成分过多或过少。请回答下列问题:
①大米的主要成分在人体内最终变成了(填名称)而被人体吸收。
②蔬菜、水果中维生素C的含量较高,缺乏维生素C的同学在膳食中应该增加蔬菜、水果的摄入量,许多蔬菜、水果(如柠檬等)是(填“酸性食物”或“碱性食物”)。
(2)2005年10月12日,中国自主研制的“神舟六号”载人飞船,在卫星发射中心发射升空,准确进入预定轨道,并成功返回。
钛作为一种重要的航天金属,在“神州六号”飞船上得到广泛的应用,航天员所用的“手杖”即是用钛制成,工业上可用钠、镁还原钛的卤化物(熔融状态)来制备,写出镁还原四氯化钛的化学反应方程式_________________________________________。
下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题:
| ① |
② |
||||||||||||||
| ③ |
④ |
⑤ |
⑥ |
(1)①元素在周期表中的位置是第二周期族。
(2)②和⑤两种元素中原子半径较大的是(填元素符号)。
③和④两种元素的最高价氧化物对应水化物中碱性较强的是(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式。