实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液。
Ⅱ.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
Ⅲ.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
(1)滴定达到终点的现象是 ① ,此时锥形瓶内溶液的pH范围为 ② 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。
甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(7分)(1)实验测得:在室温下1L水中只有10-7mol的水电离,列式计算水的电离平衡常数KH2O;
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示,则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由。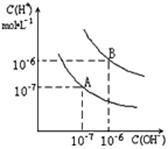
(12分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。( ,计算结果保留小数点后1位)
,计算结果保留小数点后1位)
(11分)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是 ________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为____。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图所示实验装置,回答下列问题:

(1)写出下列仪器的名称:①,②,④。
(2)仪器①~④中,使用时必须检查是否漏水的是 (填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是,将仪器补充完整后进行的实验操作的名称为;②仪器的进水口是(填“f”或“g”)。
(4)现要配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:。
A、B两种固体物质的溶解度曲线如下图所示。请回答: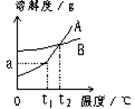
(1)℃时,A、B两种物质的溶解度相同;
(2)我国有些地区有一种说法:“冬天捞碱,夏天晒盐”。这里的碱指Na2CO3,盐是指NaCl。那么,图中__________(填A或B)的溶解度曲线与Na2CO3的溶解度曲线相似;
(3)人们用上述方法从盐湖中捞得的Na2CO3(常含有少量的NaCl)。试计算Na2CO3的摩尔质量为,2mol Na2CO3中约含有个碳原子;
(4)某研究性学习小组对捞得的碱进行分析,称取Na2CO3固体(含有少量的NaCl)样品12.5g,将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到0.1molCO2气体。该反应的化学方程式为,上述样品中含Na2CO3的物质的量为,质量为。