已知下列各物质都是由短周期元素组成,它们之间的关系如下图所示:

常温下,A、F为金属单质,F既能与L溶液反应,又能与N溶液反应。C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R焰色反应均为黄色。请回答:
(1)P的结构式为 ,B的电子式为 。
(2)R的水溶液呈碱性的原因可用离子方程式表示为 。
(3)还有一种物质能与B反应生成C,写出这个反应的化学方程式 。
(4)还有一种单质能与J反应生成C,写出这个反应的化学方程式 。
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用,写出该过程中发生反应的离子方程式______________。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空: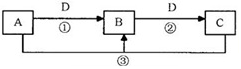
(1)若C能使品红溶液褪色,已知0.5molC被D进一步完全氧化成气态物质E,放出49.15 kJ热量,则该反应的热化学方程式为______。
(2)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,向C溶液中滴入黄色铁氰化钾 (K3[Fe(CN)6])溶液后能发生复分解反应生成蓝色沉淀,该反应的化学方程式是______
(3)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,A在一定条件下生成C是工业制HNO3重要一步,则A→C反应的化学方程式为______ 。
(4)若A、B、C三化合物的焰色反应均呈黄色,水溶液均为碱性,且浓度相同时碱性依次减弱,则反应①的离子方程式是______
A、B、C、D均为中学化学中的常见物质,请根据题中信息回答问题。
(1)已知它们存在如下反应转化关系:A +B→C +D(未配平,反应条件略去)。
①该转化关系中所涉及的反应为置换反应。
若A是金属单质,D是非金属单质,且A 原子的质子数是D原子的2倍,则反应的方程式是。
若A、D均为短周期同主族元素构成的非金属单质,B、C均为氧化物,则反应的方程式是。
②该转化关系中所涉及的反应为非置换反应。若A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是。
(2)已知它们存在如下反应转化关系:A +B→C +D+H2O(未配平,反应条件略去)。
① 该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,当A的摩尔质量小于B时,试剂B的名称为,下列试剂能用于鉴别C、D两种气体的是。
a.Ba(OH)2溶液
b.酸性KMnO4溶液
c.紫色石蕊试液
d.H2O2与BaCl2混合液
e.酸化的Ba(NO3)2溶液
f.饱和NaHCO3溶液
② 该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D 均为钠盐,C与B反应能转化为D。当参加反应的A、B物质的量之比为3∶4时,则C与D物质的量之比为。
掌握物质之间的转化,是学习元素化合物知识的基础。
(I)(1)中学常见的某反应的化学方程式为:
A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式____________;
②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是_________,该溶液还可以用_____________试剂代替。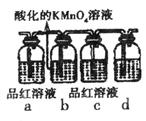
③装置d中所盛溶液是__________。
(II)下列框图所示的物质转化关系中,甲、乙、丙是常见的气体单质。气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去)。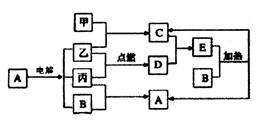
请回答下列问题:
(1)写出C的电子式:___________________________。
(2)E是_______化合物(填“共价”或“离子”,含有的化学键为__________________。
(3)写出B和丙生成A的离子反应方程式_________________________________________。
(4)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式:
______________________________________________________________________。
(14分)已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1:2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件巳略去)。
请回答:
(1)写出B单质的电子式。写出丙的结构式 。
(2)戊与强碱反应的离子方程式:____________________________。
(3)丁中所包含的化学键类型有_____________ (填字母序号)。
A.离子键B.极性共价键C.非极性共价键
(4)利用单质B与H2为原料、含H+的固体物质作电解质,在常压下用H2和用He气稀释的单质B分别通入电解池的两极,在570℃时进行反应,反应物转化率高达78%,则生成产物的电极上的电极反应式为,另一个电极上的电极反应类型是。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为:_______________。
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。巳知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为: _________________。
(16分)Ⅰ、甲、乙、丙、丁四种物质转化关系如图。
已知甲是一种导致钢铁生锈及许多还原性物质变质的单质, 化合物乙、丙、丁均含有第三周期一种相同元素R。
(1)钢铁因甲而生锈时的正极反应式为 。
(2)若乙是难溶于水的酸性氧化物。则
①R的原子结构示意图 。②乙的一种重要用途是 。
(3)若丙是离子化合物,且阴离子含金属元素R。
①工业上由乙制取R的单质伴随的能量主要转化形式是: 能转化为 能。
②R的单质与MnO2反应的化学方程式为 。
③染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入R的单质除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2¯(有丙的阴离子生成)的离子方程式为 。
Ⅱ、(4)已知一定量的C单质能在O2 (g)中燃烧,其可能的产物及能量关系如下右图所示:
1molC和1/2molO2反应生成CO的△H为 ,一定条件下CO2(g)与C(s)反应生成CO(g)的热化学方程式为 。