(普通班做)现有反应:CO(g)+ H2O(g)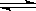 CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
(1)当CO转化率为25%时,该反应是否达平衡,向哪个方向进行?
(2)达平衡时,CO转化率为多少?
(3)平衡时,H2的体积分数为多少?
(4)平衡时,混合气体的平均相对分子质量为多少?
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2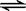 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是()
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是()
| A.2 mol SO2+ 1 mol O2 | B.4 mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2 SO3 | D.3 mol SO2+ 0.5 mol O2+ 1 SO3 |
下列溶液,阴离子总浓度最大的是( )
| A.0.2 mol / L NaCl | B.0.1 mol / L Ba(OH)2 |
| C.0.2 mol / L K2S | D.0.2 mol / L (NH4)2SO4 |
下列关于电解质溶液的叙述正确的是
| A.常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+)①<②<③ |
| B.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
某密闭容器中发生如下反应:X(g)+3Y(g) 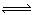 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率一定最低 |
室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH—) 分别为x mol·L-1和y mol·L-1,两者的关系正确的是()
| A.x===10?2 y | B.x==102 y | C.x===y | D.x>y |