氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
| A.分散质颗粒直径都小于l nm | B.能透过半透膜 |
C.加热蒸干、灼烧后都有氧化铁生 成 成 |
D.呈红褐色 |
科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
| A.a为正极,b为负极 | B.生产过程中H+向a电极区域运动 |
| C.电子从b极向a极移动 | D.负极反应式为: |
.以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,电池反应为: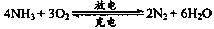
有关下列说法错误的是()
| A.氨燃料电池在放电时,氨气被氧化 |
| B.氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH- |
| C.以氨气代替氢气的主要原因是:氨气易液化易储存 |
| D.燃料电池的能量转化率一般比普通的电池高 |
下列表示可逆反应:2A(g)+B(g) 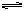 D(g) △H<0的图示中正确的是( )
D(g) △H<0的图示中正确的是( )
(atm压强的一种单位)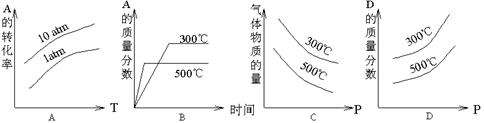
某种电池的总反应为 Fe+NiO2 + 2H2O  Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
| A.放电时Fe是负极,NiO2是正极 |
| B.放电时正极反应是:NiO2+H2O+2e-=。Ni(OH)2+2OH- |
| C.放电时负极反应为: Fe-2e-+2OH-=Fe(OH)2 |
| D.该蓄电池的电极应该浸入某种碱性电解质溶液中 |
某温度下的密闭容器中,发生如下可逆反应:2E(g)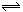 F(g)+xG(g)△H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
F(g)+xG(g)△H<0,若起始时E的浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5 a mol/L;若E的起始浓度改为2 a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( )
| A.升高温度时,正反应速率加快,逆反应速率减慢 |
| B.若x=1,容器体积保持不变,新平衡下E的体积分数为50% |
| C.若x="2,容器体积保持不变,新平衡下F的平衡浓度为0.5a" mol/L |
| D.若x="2,容器压强保持不变,新平衡下E的浓度为a" mol/L |