(12分) 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)

| 实验 |
药品 |
制取气体 |
量气管中的液体 |
| ① |
Cu、稀HNO3 |
|
H2O |
| ② |
NaOH固体、浓氨水 |
NH3 |
|
| ③ |
Na2CO3固体、稀H2SO4 |
CO2 |
|
| ④ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |
请回答下列问题:
(1)简述如何检查该装置的气密性: 。
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度。你认为是否可行?请简述原因 。
(3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有

(4)实验③中,量气管中的液体最好是 。
A.H2O B.CCl4
C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,② ,③视线与凹液面最低处相平。
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0mL |
346.3mL |
| ② |
1.0g |
10.0mL |
335.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
某校化学小组学生利用右图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。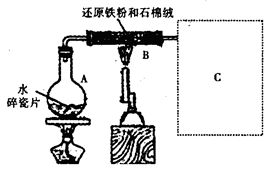
(1)装置B中发生反应的化学方程式是。
(2)虚线框图C的气体收集装置是下图中的________________________(选填字母编号)。
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:
试剂a的化学式是,试剂b的化学式是;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:;
为了对所提出的假设2进行验证,实验方案是。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为。
(14分)氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
(1)若D中品红溶液褪色,则B装置中发生反应的离子方程式是。
(2)证明FeBr2与Cl2发生了氧化还原反应后各被氧化粒子的检验方法是。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设:
假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(3)学习小组判断同时存在SO32-和ClO-是不可能的理由是______________。(用离子方程式解释)
(4)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4 b.0.01 mol/L KMnO4c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量___ (填字母),若溶液_________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量_____(填字母),若溶液_________________(填现象),则假设2成立。
某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO2,其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如下图B装置中所得100mL溶液中取出25.00ml溶液,用0.1mol/L的NaOH溶液滴定,用酚酞作指示,滴定前后的滴定管中液面的位置如上图所示,在B容器中生成硝酸的物质的量为,则Ag与浓硝酸反应过程中生成的NO2的物质的量为。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用装置进行Ag与浓硝酸反应实验,选用的理由是。
②在读取量筒内液体体积之前,应进行的操作。
(3)气体成分分析
若实验测得NO的体积为112.0ml(已折算到标准状况),则Ag与浓硝酸反应的过程中(填“有”或“没有”)NO产生,作此判断的依据是。
(14分)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将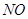 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化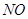 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与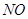 反应,能与
反应,能与 反应
反应
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前先检验装置的气密性,再加入药品,打开弹簧夹后
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
| A.加热该绿色溶液,观察颜色变化 |
| B.向该绿色溶液中通入氮气,观察颜色变化 |
| C.加水稀释绿色溶液,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
(14分)某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
2NH3 + 3CuO 3Cu + N2 +3H2O
3Cu + N2 +3H2O
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成:Cu2+和Cu:Cu2O + 2H+ ="=" Cu2+ + Cu +H2O
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是。
| A.加热氯化铵固体,再通过碱石灰 |
| B.在N2和H2的混合气体中加入铁触媒,并加热至500℃,再通过碱石灰 |
| C.加热浓氨水,再通过碱石灰 |
| D.在生石灰中加入浓氨水,再通过浓硫酸 |
(2)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是。
(3)当观察到 (填现象),即表明A中的反应已经完成。
(4)该小组欲用体积比为1︰4的稀硫酸做试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1︰4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 。
可证明还原产物中含有Cu2O的操作及现象是。
(5)请写出A中生成Cu2O的化学方程式。
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是。