在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.667mol/(L·min)
B.该反应的化学方程式为2D(s) 2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
C.已知反应的△H>0,则第5分钟时图像呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是b曲线
能正确表示下列反应的离子方程式是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ |
| C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ="HClO+" HSO3- |
| D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: |
2Al3++3SO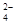 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
下列各溶液中,一定能大量共存的是
| A.Fe3+、Na+、SO42-、H2O2 | B.C2H5OH、MnO4-、H+、K+ |
| C.Pb2+、K+、SO42-、Cl- | D.Na+、SO32-、CH3COO-、S2- |
甲、乙两个电解池均以Pt为电极且互相串联。甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池阴极质量增加2.16g,乙池电极析出0.24g金属,则乙池中溶质可能是
| A.CuSO4 | B.MgSO4 | C.Al(NO3)3 | D.Na2SO4 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是()
A.25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
D.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
用下列实验装置进行相应实验,能达到实验目的的是
| A.用图2 所示装置除去Cl2中含有的少量HCl |
| B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图4 所示装置制取少量纯净的CO2气体 |
| D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层 |