下列结论错误的是
| A.氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 |
| B.微粒半径:K+>Al3+>S2->Cl— |
| C.酸性:H2SO4>CH3COOH>H2CO3>HClO |
| D.金属性:K>Ca>Mg>Be |
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生A(g)+ B(g)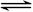 xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是
xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是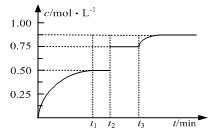
| A.方程式中x=1 | B.t2时刻改变是使用催化剂 |
| C.t3时刻改变是移去少量物质D | D.t1~t3间该反应的平衡常数均为4 |
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g) 2c(g);△H<0 x(g)+3y(g)
2c(g);△H<0 x(g)+3y(g) 2z(g);△H>0
2z(g);△H>0
进行相关操作且达到平衡后(忽略体积改变所做的功),叙述错误的是
| A.等压时,通入惰性气体,c的物质的量不变 |
| B.等压时,通入z 气体,反应器中温度升高,c的物质的量改变 |
| C.等容时,通入惰性气体,各反应速率不变,混合气体平均摩尔质量不一定增大 |
| D.等容时,通入z气体,y的物质的量浓度增大,z的质量分数增加 |
如图表示反应2SO2(g)+O2(g) 2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据此曲线判断说法可能正确的是( )
2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据此曲线判断说法可能正确的是( )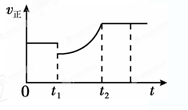
| A.t1时降低温度,平衡向正反应方向移动 |
| B.t1 时减小压强,平衡向逆反应方向移动 |
| C.t1时减小SO2的浓度,增加了SO3的浓度 |
| D.t1时增加SO2和O2的浓度,平衡向正反应方向移动 |
向Cr2(SO4)3水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着碱性增强,沉淀增多;但当[OH-1]大于0.1 mol·L-1时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。平衡关系如下:
向50mL0.05mol·L-1的Cr2(SO4)3溶液中,加入1.0mol·L-1NaOH溶液50mL,反应后观察到现象是
A.紫色B.亮绿色 C有灰绿色沉淀 D.无法判断
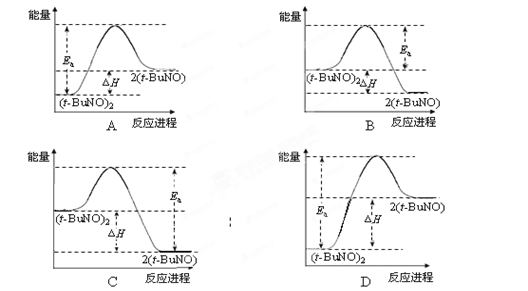
物质(t-BuNO)2在正庚烷溶剂中反应:(t-BuNO)2 2(t-BuNO),测得该反应的ΔH =" +50.5" kJ·mol-1,活化能Ea =" 90.4" kJ·mol-1。能量关系图合理的是
2(t-BuNO),测得该反应的ΔH =" +50.5" kJ·mol-1,活化能Ea =" 90.4" kJ·mol-1。能量关系图合理的是