现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示:
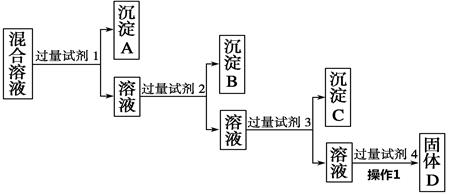
(1)写出下列物质的化学式:试剂1________,试剂2________,试剂4________,沉淀C 。
(2)加入过量试剂3的目的是__________________。
(3)在加入试剂4后,获得固体D的实验操作1分别是 、 、过滤(填操作名称)。
三瓶中分别盛有蒸馏水、暂时硬水、永久硬水,请自选试剂设计一个简单的实验,将其区别开来。
为除去粗盐中的Ca2+、Mg2+、Fe3+、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2已过量的方法是______________________________________。
(2)第④步中,相关的离子方程式是_____________________________________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
__________________________________________________。
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是______________________________________。
工业上为了处理含 离子的酸性废水,采用以下处理方法:
离子的酸性废水,采用以下处理方法:
①往工业废水中加入适量食盐。
②以铁作为阳极进行电解。
③鼓入空气。经过一段时间后,使废水中含铬量降到可排放的标准。
请用已学过的化学知识解释处理含 离子的工业废水的原因。
离子的工业废水的原因。
注:Fe(OH)3开始沉淀的pH为2.7,沉淀完全的pH为3.7。Fe(OH)2开始沉淀的pH为7.6,沉淀完全的pH为9.6,并且Fe(OH)2呈絮状沉淀,不易从溶液中除去。
(10分)下图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度为________ mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀H2SO4,则需取________ mL的该硫酸,将上述硫酸进行稀释的实验操作为
________________________________________________________________________。
(3)在配制4.6 mol·L-1的稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中:________;
②容量瓶用1 mol·L-1的稀H2SO4润洗:________;
③定容时俯视液面读数:________。
(8分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.过滤 |
(1)________分离饱和食盐水与沙子的混合物。
(2)________从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)________分离水和汽油的混合物。
(4)________分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。