(16分)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200°C,导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。工业用氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。现要通过实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①已知Al4C3与硫酸反应可生成CH4,则该反应的离子方程式是______________。
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式___________。
(2)实验装置(如下图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入过量____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量 _______(填化学式),与锥形瓶内物质充分反应。
④打开K2,通过打气装置通入空气一段时间。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据处理与问答
①在上述装置中,设置活塞K2的目的是__________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________(填“偏大”,“偏小”或“无影响”)。
③Al4C3的质量分数为 ____,AlN的质量分数为_______。
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知2SO2(g)+ O2(g)  2SO3(g)
2SO3(g) 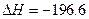 kJ·mol
kJ·mol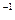 )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2mol SO2、1mol O2 |
2mol SO3 |
4mol SO3 |
SO3的浓度(mol· L L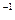 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
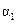 |
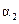 |
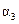 |
(1)根据上表下列说法正确的是
A.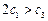 B.
B.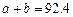 C.
C.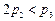 D.
D.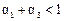
(2)甲容器中的进行反应的平衡常数表达式。
(3)甲容器平衡时SO2的转化率(用含有a的代数式表示)
(4)关于2SO2(g)+ O2(g)  2SO3(g)下列说法正确的是
2SO3(g)下列说法正确的是
A.保持容器等温等压状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
B.平衡时,测得 SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
C.反应混合物中,SO3的质量分数不再改变时反应处于平衡
D.保持容器等温等容状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
(1)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下 :
: aA (g)+ bB (g)
aA (g)+ bB (g)  2C(g)
2C(g)  起始物质的量(mol): 320
起始物质的量(mol): 320
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a=,b=;
②2S内B的反应速率=。
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:
③有个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为(不考虑溶液体积变化)。
(3)将2.3g金属钠放入足量的mg重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是(用含m的代数式表示)。
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的 稀硫酸
稀硫酸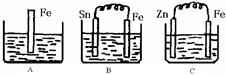
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A;B;C。
(2)一段时间后,B中Sn极附近溶液的pH(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为:(填写序号) 。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是(填写序号)。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为。
(2)反应开始至2min,以气体Z表示的平均反应速率为。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ____________(填“增大”“减小”或“相等”)。
A、B、C、D都是短周期元素,原子半径D>C>A>B。其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内质子
 数之和,C原子最外层电子数是D原子最外层电子数的4倍。
数之和,C原子最外层电子数是D原子最外层电子数的4倍。 19
19
(1)写出C元素在周期表的位置:第周期族
(2)画出元素D的离子结构示意图:。B存在同素异形现象,其中常用作消毒剂的是。(填化学式)
(3)这四种元素中的非金属气态氢化物的稳定性由大到小的顺序:(填化学式)
(4)A与B形成的三原子分子的结构式:,B与D形成的原子个数比为1:1的化合物的电子式:。
(5)C的氧化物和D的最高价氧化物对应水化物反应的离子方程式为:。