设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.pH=1的稀硫酸中含有的H+ 数为0.1NA |
| B.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| D.80g NH4NO3晶体中含有NH4+小于个NA |
已知1/2H2(g)+1/2C12(g) HCl(g);△H=-92.3kJ·mol-1,则反应2HCl(g)
HCl(g);△H=-92.3kJ·mol-1,则反应2HCl(g) H2(g)+Cl2(g)的△H1为
H2(g)+Cl2(g)的△H1为
| A.+92.3 kJ·mol-1 | B.-92.3 kJ·mol-1 |
| C.-184.6 kJ·mol-1 | D.+184.6 kJ·mol-1 |
用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是
| A.不用稀硫酸改用98%的浓硫酸 | B.加热 |
| C.滴加CuSO4溶液 | D.不用铁片改用铁粉 |
一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2 + 3H2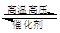 2NH3(正反应是放热反应)。下列有关说法正确的是
2NH3(正反应是放热反应)。下列有关说法正确的是
| A.达到化学反应限度时,可生成2mol NH3 |
| B.向容器中再加入N2,可以加快反应速率 |
| C.降低温度可以加快反应速率 |
| D.1mol N2和3mol H2的总能量低于2mol NH3的总能量 |
某元素最高正价与负价绝对值之差为4,该元素的离子与跟其核外电子排布相同的离子形成的化合物是
| A.K2S | B.MgO | C.MgS | D.NaF |
下列各组元素的原子序数中,其相应的元素原子能形成X2Y 共价化合物的是
| A.3与8 | B.1与16 | C.12与17 | D.6与8 |