实验室需要配制0.55mol·L-1 NaOH溶液220 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平、烧杯、玻璃棒、胶头滴管_________、___________。
(2)计算。配制该溶液需取NaOH晶体________g。
(3)称量。
①天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置,假设烧杯质量为50g:
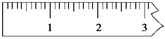
②称量过程中NaOH晶体放于天平的右盘,实际称得NaOH的质量为__________g。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是____________________。
(5)转移、洗涤。在转移时应使用玻璃棒引流,应注意_______;需要洗涤烧杯2~3次是为了________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有__________(填字母,下同);偏小的有_____________;
无影响的有_____________。
| A.称量时用生锈的砝码 |
| B.将NaOH放在纸上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时有少量液体溅出 |
E、未洗涤溶解NaOH的烧杯
F、定容时仰视刻度线
G、容量瓶未干燥就用来配制溶液
某化学课外小组用右图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。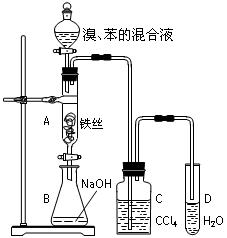
(1)写出A中反应的化学方程式:________________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________________________。
(3)C中盛放CCl4的作用是_____________________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
| 向试管D中加入的试剂 |
能证明苯与液溴发生取代反应的现象 |
|
| 方法一 |
||
| 方法二 |
为定性探究乙醇的分子结构,某化学课外小组设计了如下实验方案:在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有医用注射针头的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上(如图),在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊。
(1)以上实验设计存在重大安全隐患,请你帮他们指出来______________________。
(2)确认所用乙醇为无水乙醇的方法是______________________________________。
(3)若向烧杯中加入少量澄清石灰水后发现有混浊,那么燃烧产生CO2的物质最可能是_________________。
(4)若向烧杯中加入少量澄清石灰水后未发现混浊,则可推断乙醇分子结构中含有__________________________________________。
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称和所需主要实验仪器:
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③,步骤⑤。
(2)写出步骤④对应反应的离子方程式:。
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用(填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是。
(4)提取碘的过程中,可供选择的有机试剂是。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是。
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 E.干馏 F.蒸馏 |
G.电解 H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化;(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质。
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下: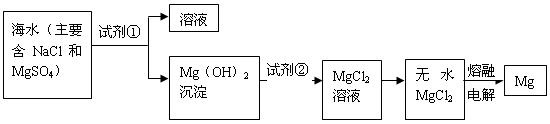
(1)为了使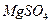 转化为
转化为 ,试剂①可以选用,要使
,试剂①可以选用,要使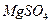 完全转化为沉淀,加入试剂①的量应;
完全转化为沉淀,加入试剂①的量应;
(2)加入试剂①后,能够分离得到 沉淀的方法是;
沉淀的方法是;
(3)试剂②可以选用;
(4)无水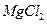 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生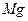 和
和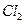 ,该反应的化学方程式为:
,该反应的化学方程式为:
。