现有A、B、C、D、E、F六种化合物,已知它们的阳离子分别是K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子分别是Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,将它们分别配成0.1 mol/L的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应现象所涉及的离子方程式是_____ ________。
(2)E溶液中溶质的名称是___________,判断依据是__________。
(3)写出下列四种化合物的化学式:
A:_______________ C:_____________ D:_______________ F:_______________
X2是人体呼吸中不可缺少的气体,Y是地壳中含量最多的金属元素,Z元素的焰色为黄色,W2是一种黄绿色气体。请回答下列问题:
(1)写出Z的元素符号,画出X的原子结构示意图;
(2)工业上利用W2和消石灰制取漂白粉,则漂白粉的有效成分是;
(3)Z元素组成的两种盐A、B在一定条件下可以相互转化,A、B都可与足量盐酸反应且产物完全一样,其中A是发酵粉的主要成分之一,则B通过化合反应转化为A的化学方程式;
(4)工业上是通过电解Y2X3冶炼Y单质,若生成了0.1 mol Y单质,则转移mol电子;
(5)今有MgSO4和Y2(SO4)3的混合溶液,已知c(SO42-)=1.5mol·L-1。则溶液中c(Y3+)=mol·L-1。其中,往一定体积该混合溶液中加入Z单质的物质的量与生成沉淀的物质的量的关系如图:
(1)写出Na2CO3在水溶液中电离的电离方程式。
(2)在3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O的反应中,作为氧化剂的物质是(填化学式);用双线桥法,标出该氧化还原反应的电子转移情况和数目。
(3)在一定条件下,RO3n-和氯气可发生如下反应:
RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O由以上反应可知RO3n-被(填“氧化”或“还原”), RO3n-中元素R的化合价是。
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)在一个密闭容器中,发生反应:C(s)+H2O(g)  CO(g)+H2(g)则该反应正向反应是:反应(填:放热、吸热),该反应化学平衡常数表达式为K=,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向反应方向移动,v(正) (填:不变、变大、变小)。
CO(g)+H2(g)则该反应正向反应是:反应(填:放热、吸热),该反应化学平衡常数表达式为K=,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向反应方向移动,v(正) (填:不变、变大、变小)。
(2)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇(CH3OH)。
①已知在常温常压下:2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)∆H = -566.0 kJ/mol
H2O(g)=H2O(1)∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从(填“c”或“b”)口通入,电池负极反应式为_______________________________。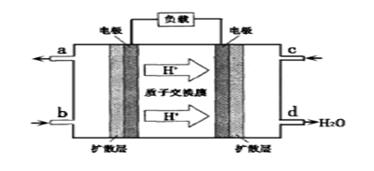
(3)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g) ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是______________。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,0.5分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=________mol/(L•min),若继续通入0.20mo1SO2和0.lmolO2,则达平衡时SO2的转化率_______(填“不变”、“增大”“减小”)
(5)25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a.NH3·H2Ob.CH3COONa c.NH4Cl d.NaHSO4
常温下呈酸性的溶液有(填序号)。
(2)已知25CO时,醋酸的Ka=1.8×10-5 碳酸的Ka1=4.3×10-7 Ka2=5.6×10-11。有①NaHCO3溶液②CH3COONa溶液③NaOH溶液各25 mL,浓度均为0.1 mol·L-1三种溶液的pH由大到小顺序为(请用序号填空);已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示:______________________________、__________________________,该溶液中的离子浓度由大到小的顺序是:_____________________
(3)有浓度均为0.1 mol•L-1的 ①盐酸②硫酸③醋酸三种溶液,(请用序号填空) 三种溶液的pH由大到小的顺序为;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为;
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式:,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)=mol/L(忽略溶液体积的变化)。
【化学——选修3:物质结构与性质】人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)CH三CH、乙烷分子中的碳原子杂化类型分别为__________、______,甲烷的空间构型是________,该空间构型中,键角____(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有_____个钙离子,研究表明,哑玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。