(14分)实验室有一瓶碳酸钠试剂,含少量Na2SO4杂质.某学生设计如下实验来确定其纯度.
(1)有以下实验操作步骤,其正确的操作顺序是____________.
| A.称取样品W1 g |
| B.加盐酸酸化 |
| C.用蒸馏水溶解 |
| D.过滤 |
E.加入过量的氯化钡溶液
F.洗涤
G.干燥
H.称量沉淀质量为W2 g
(2)酸化时盐酸是否需过量,其原因是_____________。
(3)BaCl2溶液要过量的目的是__________________。
检验BaCl2已过量的方法是_________。
(4)洗涤的目的是______________,检验沉淀已洗干净的方法是__________。
(5)样品中Na2CO3的纯度为____________。
为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。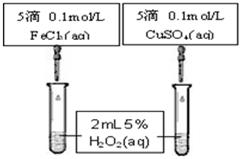
①可通过观察来定性比较得出结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是,你认为还可以作何改进?。
试回答下列问题:
(1)下列实验中所选用的仪器或操作以及结论不合理的是____。
| A.用托盘天平称量11.7g氯化钠晶体 |
| B.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成 |
| C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠 |
| D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上与标准比色卡比较 |
E.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH3COOH溶液
F.用锌和稀硫酸制H2时,为了使制取H2的速率加快,可以向稀硫酸溶液中加入少量CuSO4溶液
G.用碱式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液;
H.不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
I.用瓷坩埚高温熔融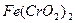 和
和 固体混合物;
固体混合物;
J.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备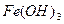 胶体;
胶体;
K.配制 饱和溶液时,加入少量的稀硫酸.
饱和溶液时,加入少量的稀硫酸.
(2)欲量取20.00mL Na2CO3溶液,应选用的仪器是。
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。
(4)在硫酸铜晶体中结晶水含量的测定实验中,称量操作至少要进行次。
某兴趣小组同学共同设计了如图所示的实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
⑴打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,但装置II只能收集H2、NH3,不能收集O2。其理由是。
乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。你认为他的改进方法是。
⑵打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是;仪器D在该装置中的作用是。
丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是。
(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。
(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
| 氢氧化物 |
Fe(OH)3 |
A1(OH)3 |
| 开始沉淀pH |
1.5 |
3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是
,应控制pH的范围是,反应的离子方程式是;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是,反应的离子方程式是;
(3)已知:①CO2(g)==C(s)+O2(g);△H="393.5" kJ·mol-l
②CO(g)+ O2(g)==CO2(g);△H=-283 kJ·mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H ="141" kJ·mol-l
写出TiO2与Cl2+C反应的热化学方程式。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是(填分子式)。产生这种结果的主要原因是(用离子方程式表示)。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
①组装好仪器后,盛放药品前,必要的一个操作是。
②A中加入的试剂可能是,作用是。
B中加入的试剂可能是,作用是。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是,D中最好选择的试剂是。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞