Na2O2与水的反应实际是Na2O2 +2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑。为了测定某过氧化钠固体的纯度,今做如下实验:
①称取过氧化钠固体2.00g
②把这些过氧化钠固体放入气密性良好的气体发生装置中
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平
④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切
⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为______的量筒
(2)该实验应选用______(填“酸式”或“碱式”)滴定管
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,若此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是 。

(4)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是 。
(5)该过氧化钠的纯度为______(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)。
药用有机物A为一种无色液体.从A出发可发生如下一系列反应
请回答:
(1)写出化合物F结构简式: 。
(2)写出反应①的化学方程式:
。
(3)写出反应④的化学方程式:
。
(4)有机物A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体
有种
(5)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应.试写出H的结构简式: 。
E的另一种同分异构体R在一定条件下也可以发生银镜反应,但不能和金属钠反应放出氢气.试写出R的结构简式: 。
某化学兴趣小组为探索铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答: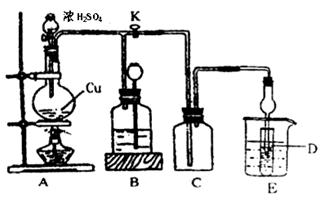
I.实验中甲同学取a 克 Cu 片和12ml 18mol/L浓H2SO4放人圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
(1)请写出Cu与浓H2SO4反应的化学方程式:。
装置E中试管D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是__________。
实验装置D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)_________。
(2)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生进入B,B中应放置的液体(填字母):________
A.饱和Na2SO3溶液 B.酸性 KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸但未能使Cu完全溶解呢?
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是_________。
A.Fe粉 B.BaCl2溶液 C.Ag D.饱和NaHSO3溶液
(4)实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是___(填名称),反应方程式是______。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1) 哪一时间段(填0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是。
(2)哪一段时段的反应速率最小,原因是
(3)第2 ~ 3分钟时间段以盐酸的浓度表示的该反应速率(设溶液体积不变)是
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液D.Na2CO3溶液
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题: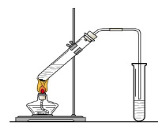
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中按一定比例将乙醇、乙酸混合后充分加热,在右边小试管中未收集到有香味的液体(气密性良好),原因可能是:
。
(3)右边小试管中应先加入的试剂是:①;②其作用是。
(4)若乙酸中的氧元素都用18O 标识,充分反应,在反应体系中含有18O 的物质共有种。
(5)下列描述能说明乙醇与乙酸的酯化反应已达到该反应的限度的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(14分)化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成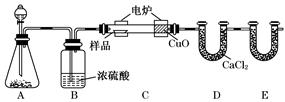
回答下列问题:
(1)A装置中分液漏斗盛放的物质是______________,写出有关反应的化学方程式______________________________________________________________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响? __________________________.
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为____.