工业上从海水中提取溴的方法如下:
①将蒸馏(制淡水)后浓缩的海水用硫酸进行酸化;
②向酸化的海水中通入足量氯气,使溴离子转化为溴单质;
③向上述溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫水溶液的吸收塔内转化成氢溴酸;
④向吸收塔内通入适量的氯气;
⑤用四氯化碳萃取吸收塔中的溴单质。
请完成下列问题:
(1)在实验室中蒸馏海水制淡水时,常用的仪器除了酒精灯、锥形瓶、牛角管、冷凝管、石棉网及必要的夹持仪器,还需要的玻璃仪器有 ;蒸馏时碎瓷片的作用是______________________
(2)步骤②中反应的离子方程式为 。
(3)步骤③的目的是使溴单质富集,试写出溴单质与二氧化硫水溶液反应的化学方程式 。
反应中________(写化学式)是氧化剂。1mol氧化剂在反应中得到_______mol电子。
(4)下列能代替四氯化碳来萃取溴的试剂是 _________(填序号)
| A.盐酸 | B.酒精 | C.乙酸 | D.苯 |
某校兴趣小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO3-10℃,SO344.8℃)
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是;装置III中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol?L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是。
某化学实验小组同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置: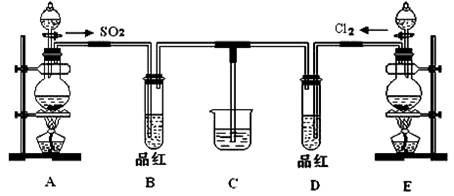
(1)用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是。
(2)实验室用装置E制备Cl2,该反应的化学方程式为,若反应中有1 mol的HCl被氧化,则反应中转移的电子总数为___ _______。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B;
D。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B;
D。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示):。
(5)SO2和Cl2均属于大气污染物,需要进行尾气处理(用装置C),则在装置C中的试剂是______________(填名称),请写出SO2和Cl2分别与该试剂反应的离子方程式,
。
(16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
废腐蚀液中加入过量铁粉后,发生反应的离子方程式为。
②检验废腐蚀液中含有Fe3+的实验操作是;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、。
③由滤渣得到纯铜,除杂所需试剂是。
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
①实验开始前,某同学对实验装置进行了气密性检查,方法是。
②浓盐酸与二氧化锰反应的化学方程式为;
烧杯中NaOH溶液的作用是。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于g,
需通入Cl2的物质的量应不少于mol.
(4分)下列实验操作或实验所得出的结论正确的是(填序号)。
A.镀锌层破损后 即对镀锌铁(白铁)制 即对镀锌铁(白铁)制 品失去保护作用 品失去保护作用 |
| B.制备Fe(OH)3胶体时,应向沸水中逐滴加入1 mol·L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 |
| C.用托盘天平称取5.85gNaCl,称量时砝码放在右盘,氯化钠放在左盘 |
| D.用灼烧闻气味的方法可以区别合成纤维和羊毛 |
E.用新制Cu(OH)2悬浊液与病人尿液共热,可检验尿液中是否含有葡萄糖
学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)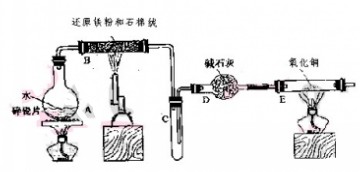
(1) 回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为__ __(填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |
经除杂后的铁粉进一步干燥后装入反应容器。
(2)反应发生后装置B中发生反应的化学方程式是___________________。
D装置的作用:_______________________.
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下: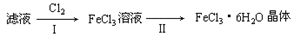
①步骤I中通入Cl2的作用
(填:氧化剂,还原剂,氧化产物,还原产物)
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理(填”合理”或”不合理”)。