(7分)实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁[Fe2(OH)n(SO4)3—n/2]m和绿矾(FeSO4·7H2O),其过程如下:
(1)过程①中,FeS和O2、H2SO4反应的化学方程式是 。
(2)验证固体W焙烧后产生的气体含有SO2的方法是 。
(3)制备绿矾时,向溶液X中加入过量 ,充分反应后,经 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH将影响聚铁中铁的质量分数,若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏 (填“高”或“低”),过程②中将溶液加热到70~80 ℃的目的是 。
(15 分)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)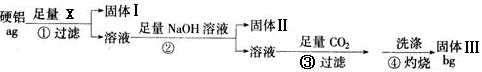
(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择(填“NaOH溶液”“盐酸”“FeCl3溶液”);步骤②的操作是,得到固体Ⅱ反应的离子方程式为
(2)固体Ⅲ的化学式为步骤④反应的化学方程式为
(3)该铝合金中铝的质量分数是________________
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果(填“偏高”“偏低”“不影响”)
(8分)按图中所示装置,用两种不同操作分别进行实验.回答有关问题: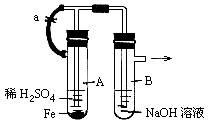
(1)按图示连接好装置,打开止水夹a,在B中可观察到的现象是:________,A中发生反应的化学方程式是;
(2)反应片刻后,夹紧止水夹a,此时可观察到的现象有:________,B中发生反应的离子方程式是:________。
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。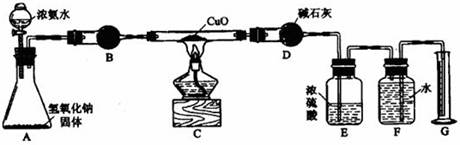
⑴写出氨气与氧化铜反应的化学方程式。
⑵在A的锥形瓶中放入NaOH固体的目的是。
⑶在干燥管B里不能选用的干燥剂是(填序号)。
A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠
⑷在C的玻管中观察到的现象是。
⑸E装置中盛装浓硫酸的目的是。
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为。(用含a、b字母的代数式表示)
某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。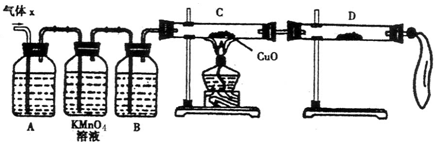
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列。
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为: 。
(1)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分,进行以下实验:取甲溶液,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成。实验过程中所发生反应的离子方程式为:;甲是溶液,乙是溶液;
(2)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中