(14分)BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如图所示。请回答:
已知:室温时Ksp[Mg(OH)2 ]=1.8×10-11,Ksp[Fe(OH)3 ]=4.0×10-38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓人预热后的空气吹出,预热空气的目的是_________;沉淀A的主要成分是_________。
(3)热空气吹除时会有部分HS-转变为S2O32-,使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为_________。
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l0-5mol 时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
(5)实验室测定产品中x的步骤如下:
①准确称取12.23 g BaCl2·xH2O样品,加入l00 mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmol H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
③将沉淀充分干燥后称量,质量为11.65 g,检验BaSO4沉淀是否洗涤干净的方法是_______;经计算x的数值为_________。
(11分) 某同学做了如下实验:用三支试管、水槽、胶塞、导管、酒精喷灯及其它必要的仪器和物品,设计了以下实验装置,完成高温下“Fe与水蒸气的反应实验”。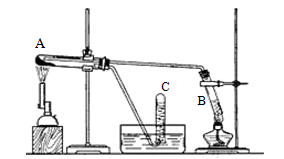
请回答该实验中的问题。
(1)写出该反应的反应方程式。
(1)试管A中装的试剂是;试管B中装的试剂是。
(2)试管C中收集气体的方法叫作;收集的气体是(填化学式)。
(3)如果要在气体导出管口点燃该气体,则必须对该气体进行。
(4)该同学欲确定反应后A试管中还原铁粉是否完全反应,其中的固体成分有哪些,设计了如下实验方案:(以下各空填化学式)
①待A试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液x;
②取少量溶液x滴加KSCN溶液,若溶液变红色则说明A试管中固体物质一定有,若溶液未变红色则说明A试管中固体物质的成分是。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是(用离子方程式表示)___________________________________________________________。
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
| 实验现象(填A~F) |
(2)实验②。
(3)实验③
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 |
A |
B |
C |
| 初始浓度/mol•L—1 |
0.020 |
0.020 |
0 |
| 平衡浓度/mol•L—1 |
0.016 |
0.016 |
0.0080 |
回答下列问题:
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
某实验小组用下列装置进行乙醇催化氧化的实验。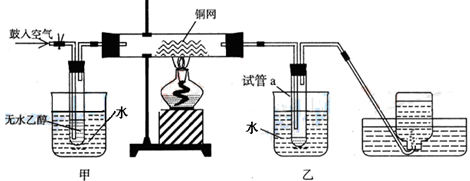
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:
、。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应
是反应(填“放热”或“吸热”)。
(2)甲和乙两个水浴作用不相同。
甲的作用是;乙的作用是。
(3)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中可能还含有的物质的名称是;要除去该物质,可在混合液中加入(此空填写字母);然后,再通过蒸馏即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
设计一个简单的一次性完成实验的装置图,目的是验证醋酸溶液,二氧化碳水溶液、苯酚溶液的酸性强弱顺序。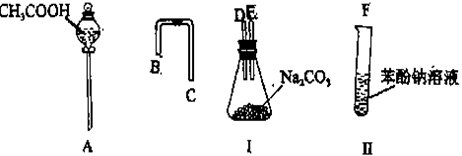
① 利用上图所示的仪器可以组装实验装置,则仪器的连接顺序为:接接接(填字母)
② 写出装置I和II中的实验现象:
I中。
II中。
③ 写出装置I和装置II中发生反应的化学方程式
I中。
II中。
你认为此实验不合适的地方是_______________________________________。