(共11分)无水氯化铝是一种重要的化工原料,利用明矾石制备无水氯化铝的流程如下: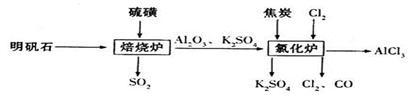
(1)下列方法中,可制得Cl2的正确组合是 。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热;③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合;⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
| A.①②⑥ | B.①②④⑥ | C.①④⑥ | D.全部可以 |
(2)写出实验室(1)中方法①制取Cl2的离子方程式 。
(3)吸收焙烧炉中产生的尾气,下列装置合理的是___________(填代号)。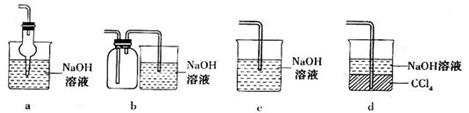
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论___________________________________。(仪器自选)
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某学习小组设计用如下装置验证二氧化硫的某些化学性质。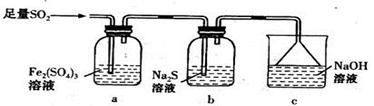
①能说明二氧化硫具有氧化性的实验现象为 。
②写出a瓶中发生反应的离子方程式 。
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去。
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀。
上述实验中能证明二氧化硫具有还原性的是_______ _(填实验代号)。
某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯。以上各物质的沸点如下:
| 物质 |
丙酮 |
乙酸乙酯 |
乙醇 |
乙酸 |
| 沸点/℃ |
56.2 |
77.06 |
78 |
117.9 |
现拟通过下列步骤回收乙醇和乙酸:
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A. 烧碱溶液 B. 浓硫酸 C.饱和食盐水 D. 浓盐酸
请回答下列问题:
(l)乙醇的沸点比丙酮沸点高的主要原因是
(2)加入甲溶液是_________,(填A B C D序号),涉及到的反应方程式:
(3)在70℃~85℃时馏出物的主要成分为________________________。
(4)在步骤④中加入过量的乙溶液是_________。(填A B C D序号),
(5)最后蒸馏的温度控制在____________。
(6)在蒸馏操作中,仪器选择及安装都正确的是:__________(填标号)
如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理?___________________
滴定法是化学上常用的定量分析的方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000 mol·L-1的标准NaOH溶液进行滴定。重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察________。(填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是:_____________________。
(3)根据下列数据:请计算待测盐酸溶液的浓度为________mol/L。
| 滴定次数 |
待测液体积(mL) |
标准NaOH溶液读数记录(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
II.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 ml于锥形瓶中,加入10.0 ml的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3="2NaI+" 2Na2S4O6。试回答下列问答:
(1)步骤①发生的化学反应方程式为:_______________;加入的指示剂是_______。
(2)步骤②应使用_________式滴定管。
(3)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是______(填序号)
A配制标准Na2S2O3溶液定容时,加水超过刻度线
B锥形瓶水洗后直接装待测水样
C装标准Na2S2O3溶液的滴定管水洗后没有润洗
D滴定到达终点时,俯视读出滴定管读数;
E滴定前尖嘴部分有气泡,滴定后消失
III.沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
2.0×10-10 |
5.4×10-13 |
8.3×10-17 |
2.0×10-48 |
2.0×10-12 |
(1)滴定时,你认为该滴定适宜选用的指示剂是下列中的___________。(填序号)
A.KBr B.KI C.K2S D.K2CrO4
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =__________。
=__________。
氯气在工农业生产在应用非常广泛。下图是实验室制备氯气并进行一系列相关实验的装置。
已知:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)仪器a的名称为_______________。
(2)装置B中饱和食盐水的作用是______________________;装置B也作安全瓶,用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_____________________。
(3)装置C的作用是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入______(填字母)。
| 选项 |
a |
b |
c |
| I |
湿润的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)装置E中氢氧化钙悬浊液的作用是______________;请写出相应反应的离子方程式:_______________。
制取氨气并完成喷泉实验
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要制取干燥的氨气可选用 做干燥剂。
(3)如图进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是 ,该实验的原理是
(4)反应后,烧瓶内的溶液中含有的微粒为 。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
(1)装置中①、②、③可以检验出的物质是① ____,②____________,③_____________。
(2)浓硫酸与木炭粉反应的化学方程式:____________________。
(3)②中第一瓶品红溶液的作用是_________________,第二瓶品红溶液的作用是_________________,酸性KMnO4溶液的作用是__________________。
(4)证明产生的气体中含有CO2的现象是:___________________。