某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯。以上各物质的沸点如下:
| 物质 |
丙酮 |
乙酸乙酯 |
乙醇 |
乙酸 |
| 沸点/℃ |
56.2 |
77.06 |
78 |
117.9 |
现拟通过下列步骤回收乙醇和乙酸:
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A. 烧碱溶液 B. 浓硫酸 C.饱和食盐水 D. 浓盐酸
请回答下列问题:
(l)乙醇的沸点比丙酮沸点高的主要原因是
(2)加入甲溶液是_________,(填A B C D序号),涉及到的反应方程式:
(3)在70℃~85℃时馏出物的主要成分为________________________。
(4)在步骤④中加入过量的乙溶液是_________。(填A B C D序号),
(5)最后蒸馏的温度控制在____________。
(6)在蒸馏操作中,仪器选择及安装都正确的是:__________(填标号)

如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理?___________________
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2:向处理过的铁屑中加入过量的3 mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研体 ⑥玻璃棒 ⑦酒精灯
(2)在步骤1中用碳酸钠溶液除去油污的化学原理是
(3)在步骤2中所加的硫酸必须过量,其原因是__________________________________
(4)在步骤3中,“一系列操作”依次为________、________和过滤;
(5)本实验制备的硫酸亚铁铵晶体常含有杂质Fe3+。检验Fe3+常用的试剂是________________,可以观察到得现象是_____________________________
某化学兴趣小组用以下装置,以环己醇制备环己烯

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热
至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
某研究性学习小组拟用硝酸钠和氯化钾混合物,来制取较纯净的硝酸钾晶体,他们设计了如下流程:
请根据以上流程,回答相关问题:
(1) 操作①的名称是。
(2)参照如下左图溶解度曲线,写出固体A、B的化学式:
A, B。欲得到较纯的硝酸钾晶体需用少量的(填“热水”,“冷水”)洗涤固体
(3)在操作②的过程中要用到减压的方法进行过滤,叫减压过滤,俗称抽滤。下图为减压过滤装置,回答有关问题。
①写出图中A、B、C三种仪器的名称:
A;B;C。
②采用减压过滤的目的是。
③请指出图中的两处错误;
④吸滤完毕时,应先拆下B与C或C和抽气泵间的橡皮管,然后关闭水龙头,其原因是。
(4)固体B中杂质的检验方法。
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志可以是_________________________________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。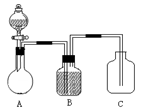
请据此实验回答下列问题:
(1)在烧瓶中装某可溶性正盐溶液,分液漏斗中所盛放的试剂应为。
(2)装置B中所盛的试剂是,其作用是。
(3)装置C中所盛的试剂是,C中反应的离子方程式是。