为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。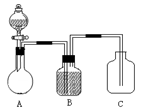
请据此实验回答下列问题:
(1)在烧瓶中装某可溶性正盐溶液,分液漏斗中所盛放的试剂应为 。
(2)装置B中所盛的试剂是 ,其作用是 。
(3)装置C中所盛的试剂是 ,C中反应的离子方程式是 。
(11分) 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5 77.1℃ C2H5OC2H5(乙醚) 34.5℃ C2H5OH 78.3℃ CH3CO
78.3℃ CH3CO OH 118℃实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸、边加热蒸馏。得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
OH 118℃实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸、边加热蒸馏。得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)写出合成乙酸乙酯的反应原理:____________________________________________。
(2)反应中加入乙醇是过量的,其目的是:。
将粗产品再经下列步骤精制:
(3)为除去粗产品其中的醋酸,可向产品中加入__________(填字母)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)再向其中加入饱和氯化钙溶液,振荡。其目的是: 。
。
(5)最后,将经过上述处理后的液体放入另一干燥的蒸馏瓶内,再蒸馏。蒸馏时,需要的玻璃仪器有:酒精灯、温度计、冷凝管、锥形瓶、尾接管和____________。冷凝管的水流方向为进出,弃去低沸点馏分,收集76—78℃沸程之间的馏分即得。
上网查阅有关煤的干馏资料,并根据下图所示煤的干馏实验,完成下列问题:
(1)指出图中各仪器的名称:
a________________,b_________________,c_________________,d_________________。
(2)装置c的作用是_________________,d中液体有_________________和_________________。其中的有机物里溶有_________________,可用_________________检验出来;有机物可通过_________________方法使其中的重要成分分离出来。
(3)e处点燃的气体是_________________,火焰是_________________色。
( 6分)如右图。在一支试管中放入一小块铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。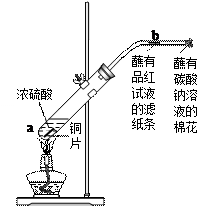
回答下列问题:
(1)试管中的液体反应一段时间后,b处滤纸条的变化为_。
待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(2)待试管中的液体冷却后,将试管上层液体倒去,再慢慢加入少量水,可观察溶液呈色。
(3)玻璃导管口蘸有Na2CO3溶液的棉花所起的作用是,有关反应的化学方程式为。
“碘钟”实验中,3I-+S2O===I+2SO的反应速率可以用I与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/(mol·L-1) |
0.040 |
0.080 |
0.080 |
0.160 |
0.120] |
| c(S2O)/(mol·L-1) |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该 实验的目的是_____________________________________________________。
实验的目的是_____________________________________________________。
(2)显色时间t1=____________________________ (3)温度
(3)温度 对该反应的反应速度的影响符合一般规律,若在40℃下进行编号③对应浓度的
对该反应的反应速度的影响符合一般规律,若在40℃下进行编号③对应浓度的 实验,显色时间t2的范围为__________(填字母)。
实验,显色时间t2的范围为__________(填字母)。
| A.<22.0 s | B.22.0 s~44.0 s |
| C.>44.0 s | D.数据不足,无法判断 |
(4)通过分析比较上表数据,得到的结论是____________。
甲、乙、丙、丁四位同学各取了0.1 mol·L-1的一元酸(他们所取的酸可能是不同的)
20.00 mL,分别向其中滴加0.1 mol·L-1的一元碱(他们所用的碱也可能是不同的),
滴加过程中不断测定混合液的pH,下表是测得的部分数据。
| 测定溶液的pH |
||||
| 加入碱溶液的体积/mL |
甲 |
乙 |
丙 |
丁 |
| 19.98 |
4.3 |
7.7 |
4.3 |
|
| 20.00 |
7.0 |
7.0 |
8.7 |
5.3 |
| 20.02 |
9.7 |
10.0 |
请回答下列问题:
(1)为了较方便准确地量取所用的酸,甲同学量取酸液时左手拿洗耳球,右手所持的玻璃量器是(填该量器的名称),向酸溶液中滴加碱溶液时,所用的仪器是。
(2)分析表中的数据,有一个数据肯定是错误的,该数据是,在回答以下问题时都应该剔除该数据。
(3)四位同学所选用的酸溶液pH最大的是(在甲、乙、丙、丁中选填)。
(4)以上酸碱用于中和滴定,试给出选用指示剂的建议(填在表格中)
| 甲 |
丙 |
|
| 建议选用的指示剂 |
(5)请计算甲同学在滴入19.98 mL 碱溶液时,溶液的pH约为(保留一位
小数,也可用对数形式表示)。
(6)一位同学用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,实验结束发现测定结果偏高,你帮他分析其原因可能是。
| A.未用标准液润洗碱式滴定管 |
| B.滴定终点时,俯视滴定管的刻度,其它操作均正确 |
C.盛装未知液的锥形瓶用蒸馏水洗过 ,未用待测液润洗 ,未用待测液润洗 |
| D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |