制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得。用以上两种方法都可制得的氯化物是
| A.AlCl3 | B.FeCl3 | C.FeCl2 | D.CuCl2 |
丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是( )
| A.能与钠反应放出氢气 | B.能与新制的Cu(OH)2悬浊液反应 |
| C.能与溴水发生取代反应 | D.能发生加聚反应生成高分子化合物 |
下列各组中的两种有机物一定是同系物的是( )
| A.CH4O和C2H6O | B.C2H4和C3H6 | C.C2H2和C3H4 | D.CH4和C3H8 |
如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中错误的是( )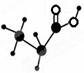
A.分子式是C3H6O2B.不能和NaOH溶液反应
C.能发生酯化反应D.能使紫色石蕊溶液变红
下列反应中,属于加成反应的是( )
| A.将苯滴入溴水中,振荡后水层接近无色 |
| B.乙烯使酸性KMnO4溶液褪色 |
| C.甲烷与氯气混合,光照后黄绿色变浅 |
| D.乙烯使溴水褪色 |
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(s),以下能说明反应达到平衡标志的是( )
Y(g)+Z(s),以下能说明反应达到平衡标志的是( )
| A.混合气体的压强不再变化 |
| B.X、Y、Z的物质的量之比为2:1:1 |
| C.单位时间内生成lmolY的同时分解2mol X |
| D.X的分解速率与Y的消耗速率相等 |