(8 分)将一定质量的铁粉加入到装有 100 mL 某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 mL(标准状况下)。
①所得溶液中的溶质的化学式为 。
②原硝酸溶液的物质的量浓度为 。
(2)向上述固液混合物中逐渐滴加稀硫酸直至刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式为 。
②(m-n)的值为 (精确到0.1 g)。
化合物A结构简式为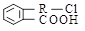 (其中R为饱和烃基),在一定条件下发生如图所示转化关系:
(其中R为饱和烃基),在一定条件下发生如图所示转化关系: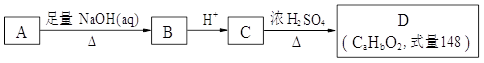
完成下列填空:
(1)关于上述各步转化,下列说法正确的是 ______(选填序号)。
a. 以上转化未涉及加成反应
b. D比C的相对分子质量小18
c. A、B、C、D中都含有—COOH
d. A跟C发生酯化反应,产物分子式为C18H18O4Cl
(2)A可能的结构简式有:_____________________________________________________。
(3)D的分子式为_________________,可能的结构有___________种。
(4)若D中除苯环外,还有一个六元环,写出A→B的化学方程式:
______________________________________________________________。
(6分)写出下列叙述中有关物质的结构简式
(1)分子式为C3H7Br的卤代烃经消去反应后得到的有机物是___________;
(2)能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是_________;
(3)含C、H、O三种元素的有机物,燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:2:2,则符合条件的有机物中最简单的一种是________________
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 |
E.干馏 F.蒸馏 G.电解 H.过滤
I.萃取 J.渗析K.盐析
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法,用字母填空)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)除去粗盐溶液中的泥沙
(3)从海水得到的无水MgCl2中提取金属镁
(4)从碘水中提取碘
(5)获得短链不饱和烃,如乙烯、丙烯、丁二烯等
(6)除去淀粉溶液中所含的食盐
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题: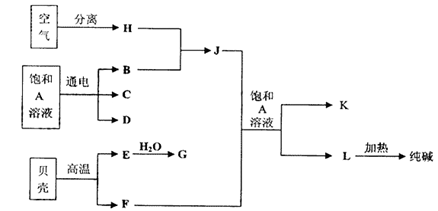
(1)电解A溶液反应的离子方程式为 ;
(2)写出C与D制取消毒剂的化学方程式 ;
(3)若要使工业合成J反应的平衡向生成J的方向移动,可采取的措施有
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离J
(4)将F和J通入A的饱和溶液中的顺序为
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
|
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
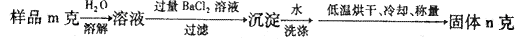
(8分) ABCDE五种物质中含有同一种元素,其相互转化关系如图所示。C是空气污染物。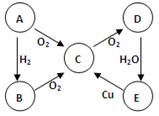
(1)如果A是淡黄色固体单质:(以下均写化学式)则C是 E是 。
写出:E→C的化学方程式
(2)如果A是无色气体: E→C的化学方程式为