下列有关铜锌原电池(下图)的叙述正确的是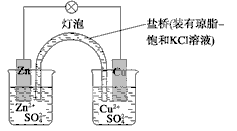
| A.正极反应为Zn-2e-===Zn2+ | B.取下盐桥,原电池仍可工作 |
| C.在外电路中,电子从正极流向负极 | D.电池反应为Zn+Cu2+===Zn2++Cu |
下列实验方案合理的是( )
| A.鉴别甲烷和乙烯:分别点燃,观察火焰的颜色及是否有黑烟 |
| B.检验酒精中的少量水:向酒精中加入足量生石灰 |
| C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D.验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液观察是否出现黄色沉淀 |
下列反应中,不属于取代反应的是( )
| A.乙醇与浓硫酸加热到140℃ |
| B.苯与浓硝酸、浓硫酸混合共热制取硝基苯 |
| C.乙醇与氧气反应生成醛 |
| D.乙醇与浓硫酸、溴化钠共热 |
下列物质既能发生消去反应生成相应的烯烃,又能氧化成相应的醛的是( )
| A.CH3OH | B.CH2OHCH2CH3 | C.(CH3)2COHCH3 | D.(CH3)3COH |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是 ( )
| A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为(7/22.4)NA |
| B.1 mol甲基(—CH3)所含的电子总数为9NA |
| C.0.5mol 1, 3-丁二烯分子中含有C=C双键数为 NA |
| D.1 mol碳正离子(CH3+)所含的电子总数为8 NA |
绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
| A.研制水溶剂涂料替代有机溶剂涂料 |
| B.用可降解塑料生产包装盒或快餐盒 |
C.用反应: 制备硫酸铜 制备硫酸铜 |
D.用反应: 制备环氧乙烷 制备环氧乙烷 |