某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下: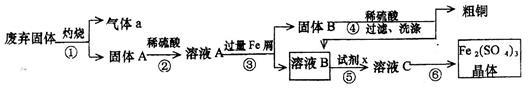
(1)除酒精灯和铁架台(或三脚架)外,①中所需的容器为_____;①和⑥中都用到的玻璃仪器为_______;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式____________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1硫酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1Fe2(SO4)3;溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证该同学的猜测是否合理。简要说明实验步骤和现象_______。
用下面两种方法可以制得白色的Fe(OH)2:沉淀方法一:用不含Fe2+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。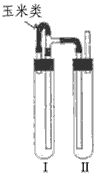
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 ______________。
(2)除去蒸馏水中溶解的O2常采用 的方法_______________。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____________ 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 _______________。
(2)在试管Ⅱ里加入的试剂是_______________ 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是___________ 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 __________。
在氯化铵溶液中撒入镁粉有何现象?并分析其原因。
下列除杂质的操作中不正确的是……( )
| A.镁粉中混有铝粉,加入过量烧碱溶液充分反应、过滤 |
| B.SO2中混有NH3,将其通过足量浓硫酸 |
| C.氯气中混有氯化氢气体,将其通过碱石灰 |
| D.Al(OH)3中混有Mg(OH)2,加入足量烧碱溶液后过滤,向滤液中通入过量CO2后过滤 |