己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中生成氨气反应的化学方程式是 _________________;
(2)B中加入的干燥剂是_______(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象:①C中______、②D中有无色液体生成;
设计实验检验D中无色液含有水:取少量液体于试管中,加入少量_______粉末,现象为______。
(4)写出氨气与氧化铜反应的化学方程式 _______________。若收集到2.24L(STP)氮气,计算转移电子数为______________。
铵明矾【NH4Al(SO4)2·12H2O】是常见的食品添加剂,用于焙烤食品,可通过硫酸铝溶液和硫酸铵溶液反应制备。用芒硝(Na2SO4·10H2O)制备纯碱和铵明矾的生产工艺流程图如图1:
完成下列填空:
31.铵明矾溶液呈性,它可用于净水,原因是;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是。
32.写出过程Ⅰ的化学反应方程式。
33.若省略过程Ⅱ,直接将硫酸铝溶液加入滤液A中,铵明矾的产率会明显降低,原因是。
34.已知铵明矾的溶解度随温度升高明显增大。加入硫酸铝后,经过程III的系列实验得到铵明矾,该系列的操作是加热浓缩、、过滤洗涤、干燥。
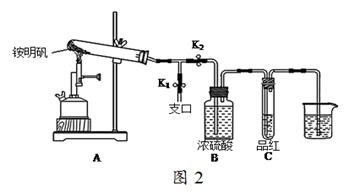
35.某同学用图2图示的装置探究铵明矾高温分解后气体的组成成份。
(1)夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是(任填一种物质的化学式);另分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式。
(2)该同学通过实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=。
(18分)用硼镁矿(主要成分为Mg2B2O5·H2O,含少量A12O3和Fe3O4)制取粗硼的工艺流程为: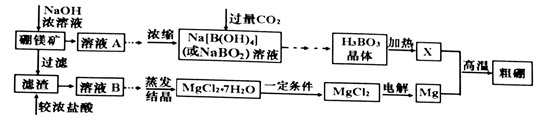
已知:①硼与铝的性质相似,也能与氢氧化钠溶液反应。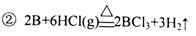
③BCl3的熔点为-107.3℃,沸点为l2.5℃,在潮湿空气中易形成白雾。
I.回答下列问题:
(1)证明溶液B中含有铁元素的方法是________________________________________
(2)Mg与X反应制取粗硼的化学方程式________________________________________
(3)上图中制取MgCl2的“一定条件”是指______________________________________
II.某同学设计如图所示装置制备三氯化硼。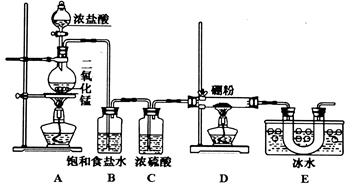
回答下列问题:
(4)E装置的作用是___________________________。
(5)如果去掉B装置,可能的后果是____________________。
(6)E装置后面还应连接的一个装置是________。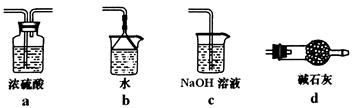
某化学小组在实验室模拟高炉炼铁,其部分装置如下: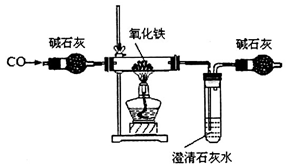
请完成下列填空:
(1)利用甲酸与浓硫酸反应HCOOH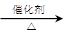 CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
(2)判断上述装置中CO与氧化铁发生反应的现象为____________;该装置存在的缺陷是__________。
(3)已知受热不均时,可发生副反应CO+Fe2O3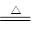 CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
①样品和稀硫酸应分别置于________、_________仪器中(填“甲”或“乙”),甲、乙试管中接口的连接方式为:A连接_______,B连接_______,C连接F(填各接口的编号)。
②量气管可以用化学实验室中一种常用仪器来改装,该仪器的名称是___________。当气体不再产生且恢复至室温时,如丙图所示量气管读数______________mL。若量气之前的其他操作均正确,根据该读数并将产生的气体体积换算为标准状况后,所计算样品中铁的质量分数将__________(填“偏大”、“偏小”或“无影响”),原因是______(若无影响该空不必作答)。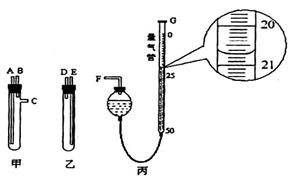
(17分)工业上煅烧黄铜矿(CuFeS2)冶炼铜并得到碱式硫酸铁[Fe(OH)SO4]等其他重要化合物,主要流程如下(部分反应物和产物未标出):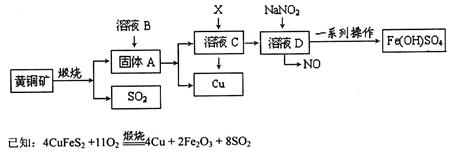
(1)溶液B是_____________________;X是__________________________________。
(2)某同学取溶液C滴入KSCN溶液,溶液不变红,说明溶液C中不含Fe3+,其原因是________(用简单的文字和离子方程式说明):再向该溶液中滴入H2O2溶液,溶液变红色。则滴入H2O2溶液发生反应的离子方程式为___________________。
(3)在溶液D与NaNO2的反应中,常采用同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____________,如参加反应的O2有11.2L(标况),则相当于节约NaNO2物质的量为______________mol。
(4)该法得到的金属铜中常含有金、银、铁、镍等金属杂质,常用电解精炼的方法得到纯铜,请在右边框内画出其原理装置示意图。
(5)[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,它溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________。
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
按要求回答下列问题
(1)第②步操作中,氧化性强弱顺序:ClO3-______MnO2(填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________。
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是 。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是____________(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。