氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 。
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 。
(1)CCS技术是将工业和有关能源产业中所生产的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一。其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如图所示(部分条件及物质未标出)。回答下列问题:
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(1)转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)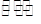 CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
①根据上图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率v(H2)=
②t min至2tmin时速率变化的原因可能是;
③3tmin时对反应体系采取了一个措施,至4tmin时CO的物质的量为0.5mol,请完成上图CO的曲线。
(3)某同学按下图所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol/L硫酸铜溶液。当装置Ⅱ中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8)。
①装置Ⅰ中、H+向极(填“a”或“b”)移动;b电极上发生的反应为。
②铜的相对原子质量的表达式为(用m和V1的代数式表示)。
已知某纯碱样品中含有NaCl杂质,为测定样品中纯碱的质量分数,甲同学用下图装置及试剂进行实验(夹持仪器略)。填写下列空白处。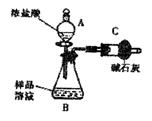
(1)仪器A、B的名称分别是 、。
、。
(2)甲同学按实验正常操作的主要步骤如下:
①;
②将ag试样放入仪器B中,加适量蒸馏水溶解,得 到样品溶液;
到样品溶液;
③称量盛有碱石灰的干燥管的质量为bg;
④ 从仪器A中滴入浓盐酸,直到不再产生气体时为止;
从仪器A中滴入浓盐酸,直到不再产生气体时为止;
⑤再次称量盛有碱石灰的干燥管的质量为cg;
(3)甲同学根据以上实验求得的样品中Na2CO3的质量分数是(用含a、b、c的式子表示)
(4)乙同学认为甲同学在实验装置设计和使用药品上都有缺陷,会导致测得的Na2CO3的质量分数偏高,而丙同学则认为甲同学的实验装置会使测得的结果偏低,丙同学认为结果偏低的原因可能是:。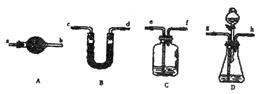
(5)若要解决乙、丙同学指出的甲同学实验中的问题,可对甲同学的实验装置和实验药品进行适当的改动,请按合理顺序选择仪器并完成下表:(用大写字母代表仪器,仪器可重复使用,夹持仪器略)
| 选用的仪器 |
|||||
| 添加的药品 及必要的操作 |
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。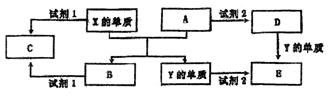
回答下列问题:
(1)X的单质与A反应的化学方程式是。
(2)若C溶液显碱性,则试剂1是液溶(写化学式):若C溶液显酸性,则显酸性的原因是(用离子方程式表示)。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是;
②写出D→E反应的离子方程式;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平):
。
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是(写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: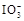 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在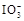 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是(填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是(填序号)。
I、关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是。
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为。
③根据上述反应可推知。(填序号)
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
④在该反应中,氧化剂与还原剂的物质的量之比为。