下列叙述错误的是
| A.常温下,将pH=11的氨水和pH=3的盐酸等体积混合后,所得溶液中各离子浓度的关系是c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.在BaSO4饱和溶液中加入少量的BaCl2溶液产生沉淀,平衡后的溶液中: (Ba2+)×c(SO42-)>Ksp(BaSO4);c(Ba2+)>c(SO42-) |
C.某二元酸的电离方程式为H2B=H++HB-,HB- H++B2-,所以NaHB溶液呈酸性 H++B2-,所以NaHB溶液呈酸性 |
| D.等浓度的NH4HSO4、NH4Cl、NH3.H2O溶液中c(NH4+)逐渐减小 |
某元素的一种同位素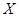 的原子质量数为
的原子质量数为 ,含
,含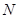 个中子,它与
个中子,它与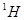 原子组成
原子组成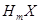 分子,在
分子,在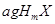 中所含质子的物质的量是( )
中所含质子的物质的量是( )
A.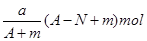 |
B.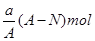 |
C.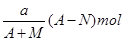 |
D.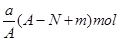 |
下列物质中都是既有离子键又有共价键的一组是()
A. 、 、 、 、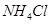 |
B. 、 、 、 、 |
C.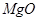 、 、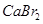 、 、 |
D.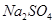 、 、 、 、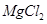 |
A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n > m ,则下列关系正确的是()
A.a> b > cB. a > c > b
C.a =" b" + m + n D.a =" c" – n – m
将0.15 mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250 mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05 mol/L | B.0.1 mol/L | C.0.2 mol/L | D.0.3 mol/L |
在下列实验过程中,出现的“异常”现象的解释,不正确的是
| A.金属钠投入到硫酸铜溶液中,生成黑色沉淀物,是因为氢氧化铜的生成 |
| B.过氧化钠加入到含有酚酞的水中,溶液变红再变无色,可能有强氧化性物质生成 |
| C.过量的二氧化碳通入澄清石灰水中,溶液变浑浊再变澄清,说明最终生成可以溶于水的盐 |
| D.在氯化亚铁的溶液中,滴加氢氧化钠溶液 ,先有白色沉淀,随后变灰绿色再变红褐色,说明氢氧化亚铁易被空气中的氧气氧化 |