已知在25℃,101kPa下,l g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
| A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g); △H=-48.40kJ·mol-1 |
| B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1 |
| C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1 |
| D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1 |
高温下,某反应达平衡,平衡常数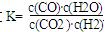 ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强, H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为 CO + H2O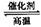 CO2 + H2 CO2 + H2 |
在一定温度下,向a L体积固定的密闭容器中加入1 mol X气体和2 mol Y气体,发生 如下反应:X(g) + 2Y(g)
如下反应:X(g) + 2Y(g)  3Z(g)。下列说法不正确的是
3Z(g)。下列说法不正确的是
A.容器内压强不随时间变化而变化
B .某一时刻,容器内各物质的浓度有可能相等
.某一时刻,容器内各物质的浓度有可能相等
C.达到平衡时,单位时间内生成 3n mol Z,同时生成 2n mol Y
3n mol Z,同时生成 2n mol Y
D.X,Y的转化率相等
体积相同的甲、乙两个容器中,分别充有2 mol SO2和1mol O2,在相同温度下发生反应2SO2+O2 2SO3,并达到平衡.在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡.在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
一些烷烃的燃烧热如下表:
| 化合物 |
燃烧热/kJ/mol |
化合物 |
燃烧热/kJ/mol |
| 甲烷 |
891.0 |
正丁烷 |
2 878.0 |
| 乙烷 |
1 560.8 |
异丁烷 |
2 869.6 |
| 丙烷 |
2 221.5 |
2甲基丁烷 |
3  531.3 531.3 |
下列表达正确的是
| A.正戊烷的燃烧热大约是3 540 kJ/mol |
| B.热稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ/mol |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
对于可逆反应A(g)+2B(g) 2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是
2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是
| A.增大压强 | B.减少B的浓度 | C.减少A的浓度 | D.升高温度 |