下列实验或反应中,最后固体质量增加的是
| A.铜丝在空气中灼烧后迅速伸入乙醇蒸气中 |
| B.铁粉与硫粉物质的量之比为1:1时混合加热 |
| C.锌粉加入到氯化铜溶液中 |
| D.去除氧化膜的铝条插入到浓硝酸中 |
美国加州Miramar海军航空站安装了一台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为2H2+O2 2H2O,负极反应为H2+C-2e-
2H2O,负极反应为H2+C-2e- H2O+CO2。则下列推断中正确的是( )
H2O+CO2。则下列推断中正确的是( )
A.正极反应:4OH--4e- 2H2O+O2↑ 2H2O+O2↑ |
| B.当电池生成1 mol H2O时,转移4 mol电子 |
| C.放电时C向负极移动 |
| D.放电时C向正极移动 |
质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2+4H++4e- 2H2O
2H2O
②负极反应为:2H2-4e- 4H+
4H+
③总的化学反应为:2H2+O2 2H2O
2H2O
④氢离子通过电解质向正极移动
A.①②③ B.②③④C.①②④ D.①②③④
氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:
负极:2H2+4OH--4e- 4H2O正极:O2+2H2O+4e-
4H2O正极:O2+2H2O+4e- 4OH-
4OH-
所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为( )
| A.8.9×10-3 mol |
| B.4.5×10-2 mol |
| C.1.1×102 mol |
| D.5.6×10 mol |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。该电池工作时,有关说法正确的是( )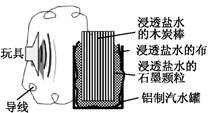
| A.铝罐将逐渐被腐蚀 |
B.石墨颗粒和炭棒上发生的反应为:O2+4e- 2O2- 2O2- |
| C.炭棒应与玩具电机的负极相连 |
| D.该电池工作一段时间后炭棒和石墨颗粒的质量会减轻 |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(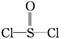 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |