H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)S简单离子的原子结构示意图为 。
(2)H2O2是实验中常用的“绿色氧化剂”,1molH218O2的中子数为____________。
(3)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示_______________。
(4)粉末状的Si3N4对空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在一定条件下的密闭容器中热处理,可以得到对空气、水、和酸都相当稳定的固体材料,同时还可生成对水不稳定的Mg3N2,热处理后除去固体材料中未反应的Si3N4、MgO和Mg3N2的方法是 。
(5)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。滤液深蓝色含有铜氨络离子-[Cu(NH3)4]2+,若沉淀质量为7.8g,则合金的质量为________g。
(6)将NO和NO2组成的混合气体通入如图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2)。
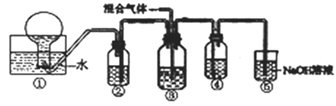
已知:
(i)浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
(ii)NaOH溶液与NO2能发生反应生成两种盐和水,NaOH溶液与NO不反应。
a.装置②、③、④中盛放的药品依次是_____ ___、 、 。
b.能够说明实验已成功的现象是____ 。
有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、NO3-、Cl-、I-,取该溶液进行如下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
⑶取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的上述离子有 。
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1) 写出一氧化碳与一氧化氮反应的化学方程式:。
(2) “催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是
。
(3) 控制城市污染源的方法可以有(多选扣分)
| A.开发氢能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下
| 时间 |
开始 |
8小时 |
16小时 |
24小时 |
32小时 |
40小时 |
48小时 |
| pH |
5.0 |
4.8 |
4.5 |
4.3 |
4.2 |
4.0 |
4.0 |
(1)放置时,雨水样品pH变化的主要原因。
(2)pH变化的离子方程式:
在一定条件下,反应3A(g) + B  2C +2D达到平衡
2C +2D达到平衡
(1)若升高温度,平衡向正反应方向移动,则逆反应是___________(填“吸热”或“放热”)反应,逆反应速率____________(填“增大”或“不变”或“变小”)
(2)若增加或减少B时,平衡不移动,则B是__________态。
(3)若增大压强,平衡向逆反应方向移动,则可判断:B是___态,C是___态,D是__态
以下表格中的实验是以CuSO4为例,分析电解质在溶液里所起的反应实质