已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;Na2O2 (s)+CO2(g)===Na2CO3(s)+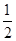 O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是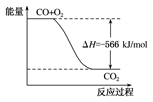
| A.CO的燃烧热为283 kJ |
| B.如图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
把100mL6mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的 ( )
| A.Na2CO3固体 | B.NaOH固体 | C.硫酸钾溶液 | D.水 |
一定条件下,可逆反应2A B+3C,在下列四种状态中处于平衡状态的是( )
B+3C,在下列四种状态中处于平衡状态的是( )
| 正反应速率 |
逆反应速率 |
| A.v(A)=2mol/(L·min), |
v(B)=2mol/(L·min) |
| B. v(A)=2mol/(L·min), |
v(C)=2mol/(L·min) |
| C. v(A)=1mol/(L·min), |
v(B)=2mol/(L·min) |
| D. v(A)=1mol/(L·min), |
v(C)=1.5mol/(L·min) |
下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )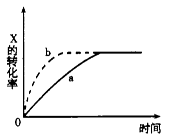
| A.升高温度 | B.加大X的投入量 | C.加催化剂 | D.增大体积 |
已知氢化锂(LiH)属于离子化合物,氢化锂跟水反应可以放出H2,下列叙述中正确的是
| A.LiH的水溶液显中性 |
| B.LiH是一种强氧化剂 |
| C.LiH中的氢离子可以被还原成H2 |
| D.LiH中的氢离子与锂离子的核外电子排布相同 |
下列物质中,含有共价键的化合物是
| A.碘化氢 | B.烧碱 | C.液溴 | D.食盐 |