某化学探究性学习小组在探究溶液导电性的实验中发现:往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,而向盐酸溶液中加入少量氢氧化钠固体灯泡的明亮程度没明显变化,他们由此得到了如下一些结论,其中合理的是 ( )
| A.溶液的导电性与溶液中离子的浓度有关 |
| B.溶液的导电性与溶液中离子的种类有关 |
| C.溶液的导电性与溶液中离子的种类和数目有关 |
| D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
根据碘与氢气反应的热化学方程式
(Ⅰ) H2(g)+I2(g) 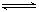 2HI(g)H="-9.48" kJ ▪mol-1
2HI(g)H="-9.48" kJ ▪mol-1
(Ⅱ) H2(g)+I2(s) 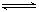 2HI(g)H="+26.48" kJ ▪mol-1
2HI(g)H="+26.48" kJ ▪mol-1
下列判断正确的是()
| A.254 g I2(g)中通入2 g H2(g)反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 |
| D.反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低 |
在36 g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s) + 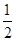 O2(g) = CO(g)△H =" -110.5" kJ/mol CO(g) +
O2(g) = CO(g)△H =" -110.5" kJ/mol CO(g) + 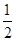 O2(g) = CO2(g)△H =" -283" kJ/mol与这些碳完全燃烧相比,损失的热量是( )
O2(g) = CO2(g)△H =" -283" kJ/mol与这些碳完全燃烧相比,损失的热量是( )
| A.172.5 kJ | B.1149 kJ | C.283kJ | D.517.5 kJ |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)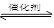 2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应平衡常数不变 |
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和水蒸气,放出609.9kJ的热量,又知:H2O (l ) ==H2O(g)△H =" +44" kJ·mol-1。下列能表示乙硼烷燃烧热的热化学方程式的是()
| A.1/3B2H6 (g) + O2 (g) ==1/3B2O3 (g) + H2O (g)△H =" -677.7" kJ·mol-1 |
| B.B2H6 (g) + 3O2 (g)="=" B2O3(s) + 3H2O (g)△H =" -2165" kJ·mol-1 |
| C.B2H6 (g) + 3O2 (g)="=" B2O3(s) + 3H2O (g)△H =" -2033" kJ·mol-1 |
| D.B2H6 (g) + 3O2 (g)== B2O3(s) + 3H2O(l)△H =" -2165" kJ·mol-1 |
已知
⑴ H2(g)+ 1/2O2(g)==H2O(g);△H1=aKJ•mol-1
⑵ 2H2(g)+O2(g)==2H2O(g);△H2=bKJ•mol-1
⑶ H2(g)+1/2O2(g)==H2O(l);△H3=cKJ•mol-1
⑷ 2H2(g)+O2(g)==2H2O(l);△H4=dKJ•mol-1
下列关系式中正确的是()
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |