700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
| 反应时间/min |
n(CO)/mol |
H2O/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0. 64,则正反应为吸热反应
对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是
| 操作 |
现象 |
结论 |
|
| A. |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| B. |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中一定有SO42- |
| C. |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D. |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中一定无NH4+ |
向含有FeBr2、FeI2的溶液中通入一定量的氯气后,再向溶液中滴加KSCN溶液,溶液变为红色,则下列叙述不正确的是
| A.通入氯气后的溶液中一定不存在I-; |
| B.通入氯气之后原溶液中的Fe2+全部被氧化; |
| C.原溶液中的Br-可能被氧化; |
| D.若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层溶液可能呈紫红色 |
向xmL2.0mol/L的盐酸中投入ag镁铝合金 ,金属完全溶解,再加入ymL1.0mol/L的NaOH 溶液沉淀达到最大值,且质量为(a+1.7)g,则下列说法不正确的是()
| A.a的取值范围为0.9g<a<1.2g |
| B.镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C.镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D.x=2y |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是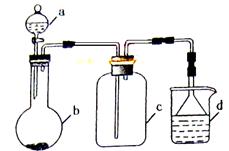
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓硝酸 |
Cu |
NO2 |
NaOH溶液 |
| B |
浓氨水 |
CaO |
NH3 |
H2O |
| C |
稀硝酸 |
Cu |
NO |
H2O |
| D |
浓硫酸 |
Cu |
SO2 |
饱和NaHSO3溶液 |
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4•5H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2 kJ•mol-1则Q1、Q2的关系为
| A.Q1<Q2 | B.Q1>Q2 | C.Q1=Q2 | D.无法确定 |