煤化工中两个重要反应为①C(s)+H2O(g)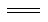 H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g)
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g) CO2(g) + H2(g)。
CO2(g) + H2(g)。
(1)下列说法正确的是 。
| A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度 |
| B.反应②的熵变△S >0 |
| C.反应①中增加C固体的量能增大反应速率 |
| D.在反应中②及时分离出产生的H2对正反应速率无影响 |
(2)若工业上要增加反应①的速率,最经济的措施为 。
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验组] |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/ min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| Ⅱ |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
| Ⅲ |
900 |
a |
b |
c |
d |
t |
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为___。
②CO(g)和H2O(g)反应的△H 0(填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是_____,与实验Ⅱ相比,化学平衡常数 (填“增大”、“减小”或“不变”)。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1 mol CO、0.5 mol H2O、0.2 mol CO2、0.5 mol H2,平衡向________方向移动(填“正反应”、“逆反应”“不移动”)。
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g) ΔH= -mkJ·mol-1
CH3OH(g) ΔH= -mkJ·mol-1
反应②: 2CO(g)+4 H2(g) CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
反应③:2CH3OH(g) CH3OCH3(g)+ H2O(g) △H<0
CH3OCH3(g)+ H2O(g) △H<0
则m与n的关系为 。
“比较法”是化学研究的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如: 2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、Na2O2与SO3(g)反应的化学方程式:
、
(2)当1 mol SO3(g)参加反应时,转移电子的物质的量为mol。
(3)通过比较可知:在氧化物中,当非金属元素处于(填“最低”、“中间”或“最高”)价时,其氧化物与过氧化钠反应就有O2生成。
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是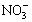 、S
、S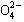 、Cl—、C
、Cl—、C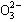 的某一种。
的某一种。
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1) 、(2)实验事实可推断它们的化学式为:
A.B.C.D.
(1)下面是唐朝刘禹锡描写沙里淘金的一首诗,其中有的诗句可能包含了化学实验现象或化学实验过程,请在这样的诗句后面写出相应的实验现象或实验过程。
日照澄洲江雾开,
淘金女伴满江隈。
美人首饰王侯印,
尽是沙中浪底来。
(2)某小苏打溶液中含NaHCO3有16.8 g,加入一定物质的量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,且无沉淀产生。请你填写出X的化学式和物质的量。
例如: X为NaOH时,物质的量为0.2 mol ;
①X为时,物质的量为;
②X为时,物质的量为;
有机物A的结构简式是 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B. C.
C.
D. E.
E.
(1)E中含氧官能团的名称为。
(2)写出A制取C、D两种物质的有机类型:C、D。
(3)写出由A制取B的化学方程式: 。
。
H是一种香料,可用下图的设计方案合成。
已知:① 在一定条件下,有机物有下列转化关系:
 ② 在不同的条件下,烃A和等物质的量HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F。
② 在不同的条件下,烃A和等物质的量HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F。
(1)D的结构简式为。
(2)烃A→B的化学反应方程式是。
(3)E+G→H的化学反应方程式。
(4)H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是:
。(用结构简式表示)