(16分)“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如右图所示。
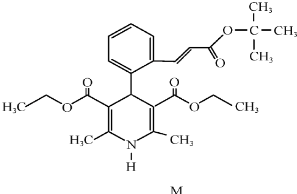
(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物 b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色 d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下:
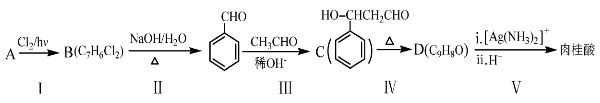
已知: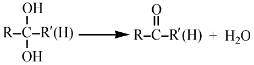
①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤II反应的化学方程式为______________。
③步骤III的反应类型是________.
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
2014年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为2NO(g)+2CO(g) 2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
(1)该反应的△H0(选填“>’’、“<")。
(2)在T2温度下,0~2 s内的平均反应速率v(N2)=
(3)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
| 化合物 |
X |
Y |
Z |
| 分子中含有的原子个数 |
/ |
4 |
/ |
| 摩尔质量/g·mol-l |
32 |
34 |
/ |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为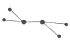 ,则X的化学式为 .
,则X的化学式为 .
(2)Y的化学性质描述正确的是。
a.不稳定性 b.弱碱性 c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH=。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)=mol·L-1。
(4)将一定量的Z气体通人NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。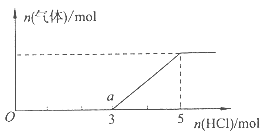
①O点溶液中所含溶质的化学式为。
②已知a点溶液呈碱性,该溶液中离子的物质的量浓度由大到小的顺序是。
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是。
②乙同学取10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b应满足的关系是(用等式或不等式表示)。
③丙同学取出10 mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是,则证明—水合氨是弱电解质。
(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
(3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,则一水合氨的电离常数Kb=。
A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。回答以下问题: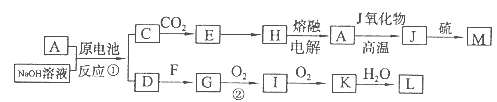
(1)A的原子结构示意图为,M的化学式为。
(2)A与NaOH溶液反应的离子方程式为。
(3)写出②的化学方程式。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。X的水溶液与NaHCO3溶液混合,反应的离子方程式为。
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: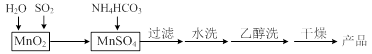
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、。
⑵①检验水洗是否合格的方法是。
②水洗结束后,用乙醇洗涤的目的是。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为;图中点D对应固体的成分为(填化学式)。