下列反应的离子方程式中正确的是
| A.Na2O2与水反应:Na2O2+ H2O = 2Na+ + 2OH- + H2↑ |
| B.FeSO4溶液与H2O2溶液混合:Fe2++H2O2+2H+═Fe3++2H2O |
| C.向Na2SiO3溶液中通入过量的SO2:SiO32- +SO2+H2O = SO3 2- +H2SiO3↓ |
| D.NH4 HCO3稀溶液与过量的Ca(OH)2溶液混合:NH4++HCO3-+2OH-+Ca2+═CaCO3↓+H2O+NH3·H2O |
反应 A+B→C(△H<0)分两步进行 ①A+B→X(△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是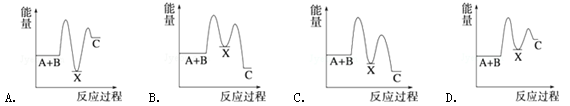
下列说法正确的是
| A.0.5molO3,与11.2 LO2所含的分子数一定相等 |
| B.25℃与60℃时,水的pH相等 |
| C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( Na0H)相等 |
| D.2SO2(g)+O2(g) = 2SO3 (g)和4SO2(g)+wO2(g) = 4SO3 (g)的△H相等 |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q |
已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g)ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
C.Cl-Cl键的键能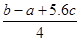 kJ·mol-1 kJ·mol-1 |
D.P-P键的键能为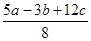 kJ·mol-1 kJ·mol-1 |
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断
| A.1,3-丁二烯和2-丁炔稳定性的相对大小 |
| B.1,3-丁二烯和2-丁炔分子储存能量的相对高低 |
| C.1,3-丁二烯和2-丁炔相互转化的热效应 |
| D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小 |