有一粗硅,含杂质铁,取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等量的H2,则该粗硅中铁和硅的关系正确的是
| A.物质的量之比为1∶1 | B.物质的量之比为1∶2 |
| C.质量之比为4∶1 | D.质量之比为2∶1 |
过氧化铬(CrO5)的结构为: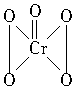 ,由此可以推知CrO5中氧元素的化合价应该是( )
,由此可以推知CrO5中氧元素的化合价应该是( )
| A.全部是-1价 |
B. 为-1价, 为-1价,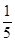 为-2价 为-2价 |
| C.全部是-2价 |
D. 为-2价, 为-2价,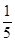 为-1价 为-1价 |
下列指定粒子的个数比为2∶1的是( )
| A.Be2+中的质子和电子 |
| B.21H原子中的中子和质子 |
| C.NaHCO3晶体中的阳离子和阴离子 |
| D.BaO2(过氧化钡)固体中的阴离子和阳离子 |
关于第ⅠA族和第ⅡA族元素的下列说法中正确的是( )
| A.在同一周期中,第ⅠA族单质的熔点比第ⅡA族的高 |
| B.浓度都是0.01 mol·L-1时,氢氧化钾溶液的pH比氢氧化钡的小 |
| C.氧化钠的熔点比氧化镁的高 |
| D.加热时,碳酸钠比碳酸镁易分解 |
NaF、NaI、MgO均为离子化合物,根据下列数据判断这三种化合物的熔点高低顺序是( )
物质 ①NaF ②NaI ③MgO
离子电荷数 1 1 2
键长/10-10 m 2.31 3.18 2.10
| A.①>②>③ |
| B.③>①>② |
| C.③>②>① |
| D.②>①>③ |
某物质熔融状态可导电,固态可导电,将其投入水中水溶液也可导电,则可推测该物质可能是( )
| A.金属 |
| B.非金属 |
| C.可溶性碱 |
| D.可溶性盐 |