我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐。为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步操作的名称是 ,第②步判断BaCl2已过量的方法是 。
(2)第④步加入试剂的化学式为 。
(3)第⑤步操作所需玻璃仪器的名称是 。
(4)若第⑤步、第⑥步顺序颠倒,将对实验结果产生影响,其原因是 。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: 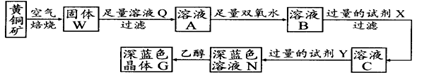
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: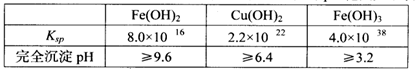
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式:;
(2)试剂X的化学式为;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为,用pH试纸测该溶液pH值的方法是;
(4)在溶液N中加入乙醇的目的是。
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题: 

I II
(1)写出上述图中仪器的名称:①;②;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有,将仪器补充完整后进行的实验操作的名称为;实验时仪器②中冷却水的进口为(选填“ f ” 或 “g ” )。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是,。
(4)下列操作,使所配溶液浓度偏小的是(填序号)。
①烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
②定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
③实验用的容量瓶洗净后未干燥,里面含有少量水
④定容时俯视
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答:
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体?
。
该反应的离子方程式是:。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程。其设计的模拟装置如下: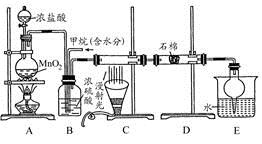
根据要求填空:
(1)B装置有三种功能:①均匀混合气体;②;③。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应。
(3)D装置的石棉中均匀混有KI粉末,其作用是。
(4)E装置的作用是(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为(填分离方法名称)。
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为(填编号)。
A.CH4 B.CH3C1C.CH2C12 D.CHCl3E.CCl4
Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8 ℃,熔点-116 ℃。实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下图Ⅰ: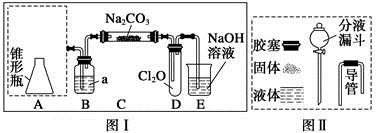
回答下列问题:
(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2。请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注。
(2)B中试剂a应选用(填字母序号)。
a.CCl4 b.饱和NaCl溶液
c.浓H2SO4 d.饱和NaHCO3溶液
(3)通入适量的氯气,在C中生成棕黄色的物质Cl2O,该物质常温下为气体,方程式为Cl2+Na2CO3+=NaHCO3+NaCl+Cl2O
(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置。
| 实验步骤 |
现象和结论 |
| 步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中。 |
|
| 步骤二:向a试管中滴加BaCl2溶液,静置。 |
无明显现象,证明固体中不含Na2CO3。 |
| 步骤三: |
|
| 步骤四: |
则证明固体中含有NaCl。 |