某消毒液的主要成分为 NaClO(混有少量 NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH溶液吸收 Cl2 制备,化学方程式为__________。
(2)该消毒液的 pH 约为 12,离子方程式为________________。
(3)向 FeSO4溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为_______________。
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。若将二者混合,每产生 1 mol Cl2,转移电子个数约为_____________。
下列反应中
①2KClO3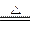 2KCl+3O2↑
2KCl+3O2↑
②C+CO2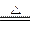 2CO
2CO
③HgS+O2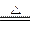 Hg+SO2
Hg+SO2
④2KMnO4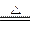 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑤2KNO3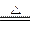 2KNO2+O2↑
2KNO2+O2↑
⑥Cl2+H2O====HClO+HCl
(1)属于一种元素还原两种元素的是__________。
(2)属于同种元素间氧化还原反应的是__________。
下图中各图象表示N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):
2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):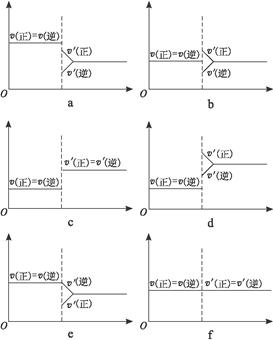
(1)表示减少H2而建立新的平衡的是图_______________;
(2)表示压缩气体体积后建立新的平衡的是图_______________;
(3)表示降低温度而建立新的平衡的是图_______________;
(4)表示体积不变充入N2、H2,同时分离出NH3建立新的平衡的是图_______________;
(5)表示加入催化剂建立新的平衡的是图_______________;
(6)表示充入氩气(体积不变)后,建立新的平衡的是图_______________。
在一个固定体积的密闭容器中加入2 mol A和1 mol B,发生如下反应:
2A(g)+B(g) 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为w mol·L-1。若维持容器体积和温度不变,用下列物质作为起始物质时,经反应达平衡后C的浓度(填“大于”“小于”或“等于”):
(1)加入1 mol A和1 mol B时,C的平衡浓度___________________________w mol·L-1。
(2)加入2 mol A和1 mol B,3 mol C和1 mol D时,C的平衡浓度___________w mol·L-1。
(3)加入3 mol C和1 mol D时,C的平衡浓度_____________________________w mol·L-1。
(4)加入2 mol B、3 mol C、1 mol D时,C的平衡浓度_____________________w mol·L-1。
(4分)常温下,浓度均为0.1 mol·L-1的①NaHCO3②NaClO③NH4Cl④NaCl⑤Na2CO3五种溶液的pH由大到小的顺序是___________。
过氧化氢H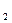 O
O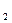 可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H
可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H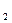 O
O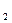 +H
+H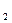 O
O
 +NH
+NH ↑。请完成下列问题:
↑。请完成下列问题:
(1)生成物A的化学式可表示为___________________________。
(2)该反应是氧化还原反应吗?____________。若是,则氧化剂是__________;若不是,请说明理由。