[化学—选修3:物质结构与性质]在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式 。
(2)B、C、D三种元素第一电离能由小到大的顺序为 (用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
(4)A2D的沸点在同族元素中最高,其原因是 。A2D由液态形成晶体时密度 (填“增大”、“不变”或“减小”),其主要原因 (用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为 (用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g·cm-3(用含a、NA的符号表示)。

将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H 2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。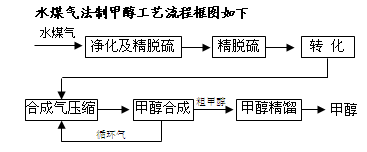
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)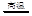 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为;
②下列能增大碳的转化率的 措施是;(填字母代号)
措施是;(填字母代号)
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4[ |
①比较此时正、逆反应速率的大小:v正v逆(填“>”、“<”或“=”)。
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =mol-1·(Lmin)-1。
(3)生产过程中,合成气要进行循环,其目的是 。
。
最近 科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下:
科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下: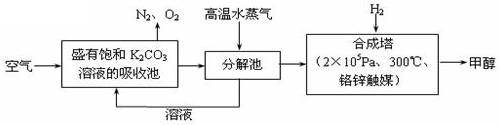
(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。 (填字母代号)
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式。当电子转移的物质的量为时,参加反应的氧气的体积是6.72L(标准状况下)。
(1)一定温度下,在恒容密闭容器中N2O5可发生下 列反应:2N2O5(g)
列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将(填“增大”、
“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
10 00 00 |
| c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2T1。(填“>”、“<” 或 “ =”)
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的区 (填“阳极”或“阴极”)生成,其电极反应式为。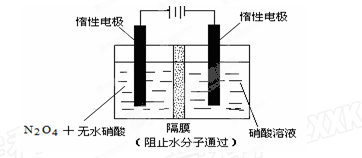
铅蓄电池是典型 的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO2-4 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原)
①放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
②在完全放电耗尽PbO2和Pb时,若按题图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将___。(填“不变”或“对换”)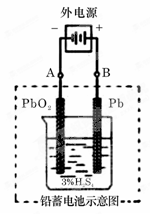
某地区用含较多Ca2+,Mg2+的天然水按照下列步骤制取蒸馏水。请回答下列问题。步骤:天然水→①沉降→②过滤→③曝气→④离子交换→⑤消毒→纯净水
(1)该地区的天然水属于(“硬水”或“软水”)。
(2)在第①步中需要加入凝聚剂,常用的凝聚剂可以是。
(3)经过第④步离子交换后要经过杀菌消毒才能直接饮用。常用的消毒方式有。
(4)若采用药剂法软化天然水,可以向其中加入碳酸钠,发生反应的离子反应方程式是
,如果是暂时硬度,可用加热的方法除去,请写出发生的化学反应方程式 (写出一个即可)。
(写出一个即可)。