【选修5:有机化学基础】以下是某课题组设计的合成聚酯类高分子材料的路线:
已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮
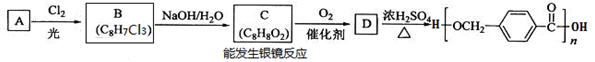
请根据以上信息回答下列问题:
(1)烃A的结构简式为 ,A的化学名称为__________。
(2)由B生成C的化学方程式为 。
(3)C的同分异构体中,既能与FeCl3溶液发生显色反应,又能发生银镜反应的有机物共有______种,其中在核磁共振氢谱中出现五组峰的有机物的结构简式为_________。
(4)D的结构简式为 ,D的某同分异构体中含有苯环的碳酸二酯在酸性条件下发生水解反应的化学方程式为 。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为
。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
(8分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为。
(2)如何运用最简方法 检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的
 。
。
(4)将经过(3)后的溶液过滤。请问这一操作能除掉哪些杂质?
。
(6分)①Cu、②液氨、③氯化钠晶体 、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石、⑧蔗糖、⑨H2S
上述物质中,能导电的是,属于电解质的是,属于非电解质的是。(填序号)
有机物A可作为合成降血脂药物安妥明( )和
)和
某聚碳酸酯工程塑料
( )的原料之一。
)的原料之一。
已知:
①如下有机物分子结构不稳定,会发生反应: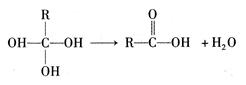
②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
相关的合成路线如下图所示:
(1)经质谱测定,有机物A的相对分子质量为58,燃烧2.9g有机物A,生成标准状况下3.36L CO2和2.7g H2O,A的核磁共振氢谱只出现一个吸收峰。则A的分子式是 。
(2)E→安妥明反应的化学方程式是 。
(3)C可能发生的反应类型是(填选项序号) 。
a. 取代反应 b. 加成反应 c. 消去反应 d. 还原反应
(4)F的结构简式是 。
(5)写出同时符合下列条件的E的同分异构体X的结构简式(只写1种即可)
。
①X能与饱和溴水发生取代反应
②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
③1mol X与足量NaHCO3溶液反应生成1mol CO2,与足量Na反应生成1mol H2
④X与NaOH水溶液发生取代反应所生成的官能团能被连续氧化为羧基
有a、b、c、d四种原子序数依次增大的常见短周期元素,a、c结合构成化合物x;b、c结合构成化合物y;c、d结合构成化合物z。元素组成的单质(仍用a、b、c、d表示)和组成的化合物之间的反应关系如下(未配平):
①x+z→c↑+n ②y+z→c↑+m ③n+y→m+x ④d+x→n+a↑
(1)上述反应中,有充分理由说明该反应一定属于氧化还原反应的是
(填反应编号)。
(2)组成化合物n的元素为 (填字母),判断理由为 。
(3)根据题意写出:z的电子式为 ,y的结构式为 。
(4)根据题意写出:反应①的化学方程式 。