(8分) 乙苯催化脱氢制苯乙烯反应:
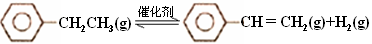
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=___________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 ___________。
②控制反应温度为600℃的理由是____________。
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法,反应为2Cu + H2O 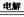 Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 ▲。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -169kJ·mol-1
C(s)+1/2O2(g)="CO(g)" △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)="CuO(s)" △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = ▲ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为▲。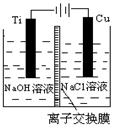
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放 出N2。该制法的化学方程式为 ▲。
出N2。该制法的化学方程式为 ▲。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: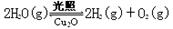 △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。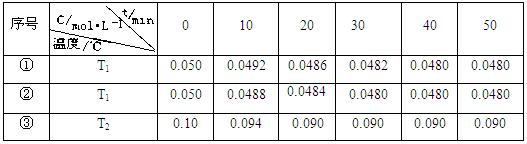
下列叙述正确的是 ▲(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率v(H2)=7×10-5 mol·L-1 min—1
C.实验②比实验①所用的催化剂催化效率高
烧结法制氧化铝生产过程如下: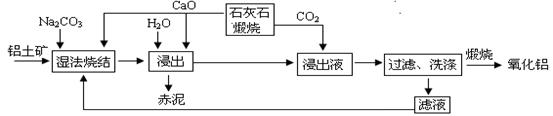
已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式 ▲ 。
(2)浸出时再加入CaO的目的是 ▲。
(3)浸出液中发生的生成Al(OH)3的离子反应方程式 ▲。
(4)滤液的主要成分是 ▲(写化学式);滤液循环使用的优点 ▲。(任答一点)
有机化合物A~F的相互转化关系如下图所示(图中副产物均未写出):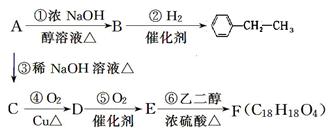
其中A的相对分子质量比 大36.5,请回答:
大36.5,请回答:
(1)按下列要求填写:
A的结构简式______________;E中含氧官能团的名称_________________。
(2)写出反应⑥的化学反应类型:________________________________。
(3)写出反应④的化学方程式:____________________________________________。
(4) B分子内处于同一平面上的原子最多有________个,B在一定条件下可以发生加成
聚合反应生成高分子化合物N,则N的结构简式为_________________。
(5)化合物M是E的一种同分异构体,M具有如下性质:①不与NaHCO3反应,②遇FeCl3溶液显紫色,③1 mol M恰好与2 mol NaOH反应,则M的结构简式为________(写一种)。
(1)A、B、C为短周期元素,请根据下表信息回答问题。
| 元素 |
A |
B |
C |
| 性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物的水溶液显碱性 |
原子有三个电子层,简单离子在本周期中半径最小 |
①第一电离能:AB(填“>”、“<”或“ =”),基态C原子的电子排布式为。
=”),基态C原子的电子排布式为。
②B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为。
(2)发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效
催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂
作用下合成甲醇(CH3OH),从而实现液化。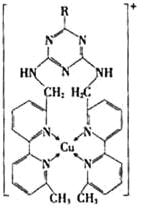
①某含铜的离子结构如图所示:
在该离子内部微粒间作用力的类型有。
a.离子键 b.极性键 c.非极性键
d.配位键 e.范德华力 f.氢键)(填字母)
②煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键。请你说明甲醛分子间没有氢键原因;
③甲醇分子中进行sp3杂化的原子有;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为。
火力发电厂释放出大量的氮氧化物(NOx).二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝.脱碳和脱硫等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为:。
2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
① 取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3,分别加入温度不同、容积相同的恒容密闭容器中,发生上述 反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,根据图示 (填写具体的线段)走向,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”.“<”或“=”)。
反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,根据图示 (填写具体的线段)走向,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”.“<”或“=”)。
② 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。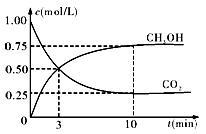
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH) > 1.5 mol·L-1且化学平衡常数K值增大。 mol·L-1且化学平衡常数K值增大。 |
| B.0~10min内,氢气的平均反应速率为0.075mol•(L·min)-1 |
| C.达到平衡时,氢气的转化率为75 % |
| D.第10min后,升高温度将使n(CH3OH)/n(CO2)减小 |
(3)脱硫。燃煤废气经脱碳处理后,用空气氧化,并用氨气吸收生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中存在着离子浓度关系为:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。