有A、L、Z、W、Q五种短周期元素,其中Z、Q同主族,A、L、Z、W同周期;A+与Q2﹣具有相同的电子层结构; L的单质晶体熔点高、硬度大,是一种重要的半导体材料;离子半径:Z2﹣>W﹣.下列说法中,正确的是
A.元素L、Z、W的单质晶体属于同种类型的晶体
B.由于W、Z、Q元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.A、Q两种元素能形成A2Q和A2Q2型化合物
D.元素W和Q的某些单质不可以作为水处理中的消毒剂
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下: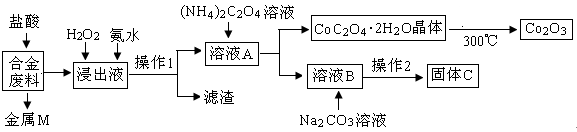
(1)金属M为,操作1为。
(2)加入H2O2的作用是(用离子方程式表示),加入氨水的作用是。
(3)充分焙烧的化学方程式为。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是,90℃时Ksp(Li2CO3)的值为。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为。
下列实验操作、现象和结论均正确的是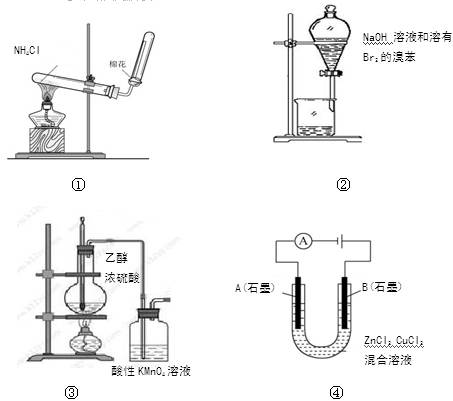
| 选项 |
操作 |
现象 |
结论 |
| A |
①将湿润的红色石蕊试纸靠近试管口 |
试纸不变色 |
NH4Cl受热不分解 |
| B |
②中振荡后静置 |
下层液体颜色变浅 |
NaOH溶液可除去溶在溴苯中的Br2 |
| C |
③加热 |
洗气瓶中溶液褪色 |
生成了乙烯 |
| D |
④通电 |
A极上有红色固体析出 |
锌的金属性比铜强 |
关于常温下0.1 mol·L-1醋酸钠溶液,下列说法正确的是
| A.水电离出来的c(OH-)=1.0×10-13 mol·L-1 |
| B.该溶液的pH<13 |
| C.溶液中离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入等浓度等体积的盐酸,溶液中:c(CH3COOH)+ c(CH3COO-)= c(Cl-)+ c(Na+) |
下列说法正确的是
| A.将高温水蒸气通过炽热的铁粉,铁粉变红色 |
| B.向Fe(OH)3胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解 |
| C.将市售食盐溶于水,滴加淀粉溶液不变蓝色,说明不是加碘盐 |
| D.Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀 |
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
| A.M与X的化合物对应的水化物一定是强酸 |
| B.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 |
| C.气态氢化物的热稳定性:M > N |
| D.离子半径r:r(X2-)> r(Y+) |