在常温常压下,取下列四种气态烃各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
| A.C4H10 | B.C2H6 | C.C3H8 | D.CH4 |
甲酸香叶酯是一种食品香料.可以由香叶醇与甲酸发生酯化反应制得。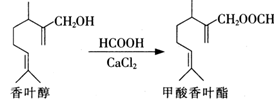
下列说法中正确的是
| A.香叶醇分子中含有1个手性碳原子 |
| B.香叶醇可发生消去、加成、氧化反应 |
| C.1 mol甲酸香叶酯可以与1molNaOH反应 |
| D.甲酸香叶酯分子中所有碳原子均可能共平面 |
下列有关说法正确的是
| A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H<0 |
| B.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
C.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 |
短周期元素X、Y、Z、W的原子序数依次增大,X是组成水的元素之一,Y原子最外层电子数是次外层的3倍;Z是地壳中含量最多的金属元素,W的原子序数是Y的2倍。下列叙述正确的是
| A.原子半径的大小顺序:Y>Z>W>X |
| B.元素Y的简单气态氢化物的热稳定性比W的弱 |
| C.由Y、Z、W四种元素组成的化合物其水溶液一定显中性 |
| D.Z元素最高价氧化物对应水化物既溶解于盐酸也溶解于氢氧化钠 |
右图是某同学设计的原电池装置,下列叙述中正确的是
| A.电极Ⅰ上发生氧化反应,作原电池的正极 |
| B.反应一段时间后,电极Ⅱ的电极质量增大 |
| C.该原电池的总反应为:2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
下列表示对应化学反应的离子方程式正确的是
| A.NO2通入水中:3NO2+H2O=2H++2NO3—+NO |
| B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O=2Cu↓+O2↑+4H+ |
| C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O |
| D.过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |