在5L物质的量浓度为2mol/l的K2SO4溶液中K+的物质的量浓度为
| A.2mol/l | B.4mol/l | C.1 mol/l | D.20mol/l |
下列热化学方程式或离子方程式中,正确的是:
| A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:有CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: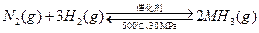 △H=-38.6kJ· △H=-38.6kJ· mol-1 mol-1 |
C.氯化镁溶液与氨水反应: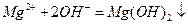 |
D.氧化铝溶于NaOH溶液: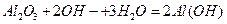 |
将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,此时溶液中符合下表关系的是( )
| NaOH的 质量分数 |
阳极析出 物质的质量/g |
阴极析出物 质的质量/g |
|
| A |
0.062(6.2%) |
19 |
152 |
| B |
0.062(6.2%) |
152 |
19 |
| C |
0.042(4.2%) |
1.2 |
9.4 |
| D |
0.042(4.2%) |
9.4 |
1.2 |
已知H2(g)+Br2(l)="2HBr(g)" △H="-72kJ/mol." 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为
| A.404 | B.260 | C.230 | D.200 |
阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为 
下列说法正确的是
| A. | 可用酸性KMnO 4溶液检测上述反应是否有阿魏酸生成 |
| B. | 香兰素、阿魏酸均可与NaHCO 3、NaOH溶液反应 |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
| D. | 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种 |
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是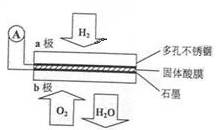
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |