掌握仪器的名称、组装及使用方法是中学化学实验的基础,右图为两套实验装置。


(1)写出下列仪器的名称:
①____________;②____________;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 ;图I实验过程中使用冷凝管时应从 处进水(均填序号)。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 ;将仪器补充完整后进行的实验操作的名称为: 。现需配制500 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 。
资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。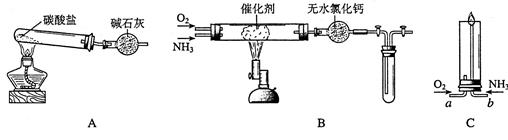
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从A、B两管进气口通人到装置C中,并在B管上端点燃氨气,两气体通入的先后顺序是:先通入______(O2 ,NH3 ),后通入__________(O2,NH3)其理由是
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,方方同学认为产生的气体除SO2外,还可能产生氢气。该同学为了验证他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答: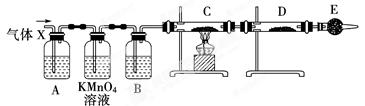
(1) E中加入的试剂是碱石灰,作用是_____________;装置A、B之间的酸性高锰酸钾溶液的作用是_________________;
(2)上述反应中生成二氧化硫的化学方程式为___________________________________;
(3)如果去掉装置B,就不能根据D中的现象判断气体X中有氢气,原因是:_______________________。
(4可以证明气体X中含有氢气的实验现象是:
C中______________________________,D中_______________________。
(14分)某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)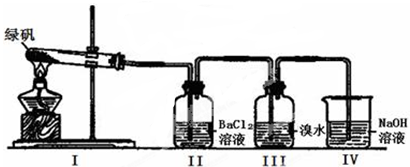
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为_________________,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。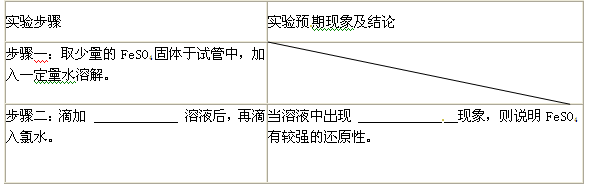
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________。
研究性学习小组进行CH4的性质探究实验。
(1)通入高锰酸钾酸性溶液,现象是____。
(2)在无色玻璃集气瓶中与Cl2混合后光照,现象是____。
(3)为了验证CH4是否具有还原性,某小组设计了如下实验: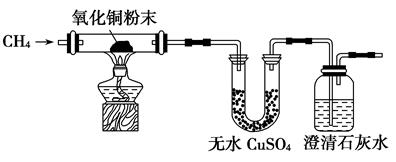
实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______。
(4)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是______。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图) ______。
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:
①取维生素C样品研碎,称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水硫酸铜和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
②将少许研碎的维生素C样品和适量的紫色石蕊试液充分混合后,溶液颜色变红。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是mo1;碳元素的质量是g。
(2)维生素C中(填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知。如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是。
(4)维生素C和紫色石蕊试液混合后,溶液颜色变红,说明维生素C溶液具有(填“酸”、“碱”或“中”)性。查阅有关资料显示,维生素C具有还原性。请以淀粉溶液、碘水为试剂,写出验证维生素C具有还原性的实验方法和现象:。