将标准状况下的a L HCl(g)溶于1 L水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是( )(水的密度为1 g/cm3)
A.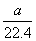 mo1·L-1 mo1·L-1 |
B.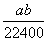 mol·L-1 mol·L-1 |
C.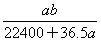 mol·L-1 mol·L-1 |
D.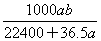 mol·L-1 mol·L-1 |
某烯烃与H2加成后的产物是 , 则该烯烃的结构式可能有
, 则该烯烃的结构式可能有
| A.1种 | B.2种 | C.3种 | D.4种 |
A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B实验式一定相同 D.A和B的化学性质相似
已知胰岛素含硫的质量分数为3.4%,相对分子质量为5734,则每个胰岛素分子中所含的硫原子数为
| A.2 | B.4 | C.8 | D.6 |
下列物质属于纯净物的是
| A.己烷 | B.聚乙烯 | C.汽油 | D.天然气 |
某1 mol链烃A在一定条件下完全裂化成1 mol烷烃B和1 mol烯烃C,生成的混合气体对H2的相对密度为14.5。试通过计算回答下列问题:
(1)写出链烃A分子式。(2)烷烃B和烯烃C可能各是什么物质?
(3)如果要求1 mol B完全燃烧时需要O2的物质的量是整数,那么C只能是什么烯烃?